题目内容
13.两种气态烃以任意比例混合,在120℃时将1L该混合烃跟9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各组混合烃中符合此实验结果的是( )| A. | C2H4、C2H2 | B. | CH4、C2H6 | C. | CH4、C2H4 | D. | C2H2、C3H6 |
分析 设有机物的平均分子式为CxHy,则有:CxHy+(x+$\frac{y}{4}$)O2→xCO2+$\frac{y}{2}$H2O,120℃时水为气体,有机物燃烧前后体积不变,则1+x+$\frac{y}{4}$=x+$\frac{y}{2}$,可得平均H原子数目,又因为两种烃以任意比混合,所以两种烃分子中H原子数目均等于平均组成中H原子数目.
解答 解:设混合烃的平均组成为CxHy,CxHy+(x+$\frac{y}{4}$)O2→xCO2+$\frac{y}{2}$H2O,120℃时水为气体,有机物燃烧前后体积不变,则1+x+$\frac{y}{4}$=x+$\frac{y}{2}$,解得y=4,又因为两种烃以任意比混合,所以两种烃分子中都必须含4个氢原子,故选C.
点评 本题考查有机物的确定,题目难度中等,注意根据有机物燃烧的通式利用平均值法解答.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
3.X、Y、Z、W是元素周期表中原子序数依次增大的前四周期元素,其相关信息如下表:
(1)W位于元素周期表第四周期第VIII族,其基态原子核外有4个未成对电子.
(2)Z的第一电离能比Y的小(填“大”或“小”);XZ2是一种常用的溶剂,XZ2分子中σ键和π键的个数比为1:1;Y的气态氢化物比Z的气态氢化物更易溶于水,其主要原因是NH3与水分子间能形成氢键,而H2S与水分子间不能形成氢键.
(3)WZ2在空气中煅烧生成W2O3的化学方程式是4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
(4)汽车尾气中含有XO、YO,在汽车排气管中装有某种催化剂能使它们转化为单质Y.已知:2XO(g)+O2(g)═2XO2(g)△H=-566.0kJ•mol-1;Y2(g)+O2(g)═2YO(g)△H=180.0kJ•mol- 1此反应的热化学方程式是2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-746.0kJ•mol-1.
| 元素 | 相关信息 |
| X | X是形成化合物种类最多的元素,其中一种单质是自然界最硬的物质 |
| Y | Y的气态氢化物能使湿润的红色石蕊试纸变蓝 |
| Z | Z的基态原子的最外层电子排布式为ns2np4 |
| W | W的一种核素的质量数为57,中子数为31 |
(2)Z的第一电离能比Y的小(填“大”或“小”);XZ2是一种常用的溶剂,XZ2分子中σ键和π键的个数比为1:1;Y的气态氢化物比Z的气态氢化物更易溶于水,其主要原因是NH3与水分子间能形成氢键,而H2S与水分子间不能形成氢键.
(3)WZ2在空气中煅烧生成W2O3的化学方程式是4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
(4)汽车尾气中含有XO、YO,在汽车排气管中装有某种催化剂能使它们转化为单质Y.已知:2XO(g)+O2(g)═2XO2(g)△H=-566.0kJ•mol-1;Y2(g)+O2(g)═2YO(g)△H=180.0kJ•mol- 1此反应的热化学方程式是2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-746.0kJ•mol-1.
4.A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如下表:
请回答下列问题:
(1)C在元素周期表中位于第三周期、第IA族;D的基态原子核外电子排布式是1s22s22p63s23p4.
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同)S2->O2->Na+,B、D的简单氢化物中稳定性较大的是H2O.
(3)B的常见单质和C的单质按物质的量比1:2反应生成的化合物中化学键的类型为离子键、共价键;该化合物属于离子晶体.
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3.
| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| B | 其一种单质被称为地球生物的“保护伞” |
| C | 元素的第一电离能是第3周期所有元素中最小的 |
| D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
| E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
(1)C在元素周期表中位于第三周期、第IA族;D的基态原子核外电子排布式是1s22s22p63s23p4.
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同)S2->O2->Na+,B、D的简单氢化物中稳定性较大的是H2O.
(3)B的常见单质和C的单质按物质的量比1:2反应生成的化合物中化学键的类型为离子键、共价键;该化合物属于离子晶体.
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3.
1.下列实验操作与实验目的不相符的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 向醋酸溶液中加入少量石灰石固体 | 验证醋酸与碳酸的酸性强弱 |
| B | 在淀粉溶液中加入20%的稀H2SO4水解后,立即加入银氨溶液做银镜反应实验 | 验证淀粉水解是否有葡萄糖生成 |
| C | 在CuSO4溶液中加入过量NaOH溶液振荡,立即加入某同学尿液并加热 | 验证该同学是否患有糖尿病 |
| D | 在乙醇溶液中插入一根灼热变黑的铜丝 | 验证乙醇是否被氧化成醛 |
| A. | A | B. | B | C. | C | D. | D |
18.如表是不同温度下水的离子积的数据:
试回答以下问题:
(1)若25<t1<t2,则a>1×10-14(填“>”、“<”或“=”).
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1.
(3)若在t2温度下测得某溶液pH=7,该溶液是碱(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合.
①若所得混合液为中性:则a:b=1:1.②若所得混合液pH=2,则a:b=9:11.
| 温度 | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
(1)若25<t1<t2,则a>1×10-14(填“>”、“<”或“=”).
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1.
(3)若在t2温度下测得某溶液pH=7,该溶液是碱(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合.
①若所得混合液为中性:则a:b=1:1.②若所得混合液pH=2,则a:b=9:11.
5.下列各组物质可用分液漏斗分离的正确组合是( )
①乙醇和乙酸
②葡萄糖溶液和蔗糖溶液
③苯和食盐水
④苯和苯酚
⑤乙酸乙酯和乙醇
⑥甲酸乙酯和纯碱溶液.
①乙醇和乙酸
②葡萄糖溶液和蔗糖溶液
③苯和食盐水
④苯和苯酚
⑤乙酸乙酯和乙醇
⑥甲酸乙酯和纯碱溶液.
| A. | ③⑥ | B. | ①③④⑥ | C. | ①②④⑥ | D. | ③⑤⑥ |
2.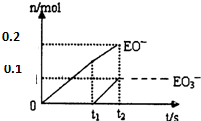 有A、B、C、D、E、F六种短周期元素,各元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,各元素特征信息如下表:
(1)D、E、F的简单离子半径由大到小的顺序是(用化学式表示,下同)S2->Cl->Al3+;
(2)D、E元素形成的化合物的水溶液呈酸性,该溶液中离子浓度的大小顺序为:c(Cl-)>c(Al3+)>c(H+)>c(OH-);
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式:H++HSO-3=SO2↑+H2O;
(4)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解.向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中D单质的质量分数为30%;
(5)一定量的石灰乳中通人一定量的E单质.两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t2时刻消耗氢氧化钙质量为37g,此时反应的化学方程式为:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
(6)A、B形成的化合物BA在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠的化合物.写出它与乙醇反应的化学方程式NaH+CH3CH2OH=CH3CH2ONa+H2↑.
 有A、B、C、D、E、F六种短周期元素,各元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,各元素特征信息如下表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
(2)D、E元素形成的化合物的水溶液呈酸性,该溶液中离子浓度的大小顺序为:c(Cl-)>c(Al3+)>c(H+)>c(OH-);
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式:H++HSO-3=SO2↑+H2O;
(4)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解.向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中D单质的质量分数为30%;
(5)一定量的石灰乳中通人一定量的E单质.两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t2时刻消耗氢氧化钙质量为37g,此时反应的化学方程式为:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
(6)A、B形成的化合物BA在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠的化合物.写出它与乙醇反应的化学方程式NaH+CH3CH2OH=CH3CH2ONa+H2↑.