题目内容
17.在PH=1的无色透明溶液中下列各组离子能大量共存的是( )| A. | H+、K+、SO42-、Cl- | B. | OH-、Na+、Cu2+、SO42- | ||
| C. | ClO-、K+、Na+、Cl- | D. | Ag+、NO3-、Br-、NH4+ |
分析 离子之间不反应生成气体、沉淀、弱电解质或发生氧化还原反应、络合反应、双水解反应且无色、和氢离子不反应的离子能大量共存,据此分析解答.
解答 解:A.离子之间不反应,且无色,和氢离子不反应,所以能大量共存,故A正确;
B.铜离子呈蓝色,且OH-和H+、Cu2+都反应,所以不能大量共存,故B错误;
C.ClO-、H+生成弱电解质而不能大量共存,故C错误;
D.Ag+、Br-生成沉淀而不能大量共存,故D错误;
故选A.
点评 本题考查离子共存,为高频考点,明确离子性质及离子共存条件是解本题关键,侧重考查复分解反应,题目难度不大.

练习册系列答案
相关题目
7.向一定量的Fe、FeO和Fe2O3的混合物中加入240mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的氢气在加热条件下还原相同质量的混合物,能得到铁的物质的量为( )
| A. | 0.48 mol | B. | 0.43 mol | C. | 0.42 mol | D. | 0.32 mol |
5.下列各组物质可用分液漏斗分离的正确组合是( )
①乙醇和乙酸
②葡萄糖溶液和蔗糖溶液
③苯和食盐水
④苯和苯酚
⑤乙酸乙酯和乙醇
⑥甲酸乙酯和纯碱溶液.
①乙醇和乙酸
②葡萄糖溶液和蔗糖溶液
③苯和食盐水
④苯和苯酚
⑤乙酸乙酯和乙醇
⑥甲酸乙酯和纯碱溶液.
| A. | ③⑥ | B. | ①③④⑥ | C. | ①②④⑥ | D. | ③⑤⑥ |
12.在硫酸铁溶液中,加入a g铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b<c,则下列判断正确的是( )
| A. | 最后得到的溶液中含有Fe3+ | B. | 残余固体可能为铁、铜混合物 | ||
| C. | 最后得到的溶液中只含Cu2+ | D. | 残余固体一定全部是铜 |
2. 有A、B、C、D、E、F六种短周期元素,各元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,各元素特征信息如下表:
(1)D、E、F的简单离子半径由大到小的顺序是(用化学式表示,下同)S2->Cl->Al3+;
(2)D、E元素形成的化合物的水溶液呈酸性,该溶液中离子浓度的大小顺序为:c(Cl-)>c(Al3+)>c(H+)>c(OH-);
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式:H++HSO-3=SO2↑+H2O;
(4)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解.向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中D单质的质量分数为30%;
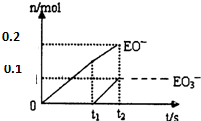
(5)一定量的石灰乳中通人一定量的E单质.两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t2时刻消耗氢氧化钙质量为37g,此时反应的化学方程式为:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
(6)A、B形成的化合物BA在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠的化合物.写出它与乙醇反应的化学方程式NaH+CH3CH2OH=CH3CH2ONa+H2↑.
 有A、B、C、D、E、F六种短周期元素,各元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,各元素特征信息如下表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
(2)D、E元素形成的化合物的水溶液呈酸性,该溶液中离子浓度的大小顺序为:c(Cl-)>c(Al3+)>c(H+)>c(OH-);
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式:H++HSO-3=SO2↑+H2O;
(4)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解.向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中D单质的质量分数为30%;
(5)一定量的石灰乳中通人一定量的E单质.两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t2时刻消耗氢氧化钙质量为37g,此时反应的化学方程式为:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
(6)A、B形成的化合物BA在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠的化合物.写出它与乙醇反应的化学方程式NaH+CH3CH2OH=CH3CH2ONa+H2↑.
6.下列化学方程式中,书写不正确的是( )
| A. | 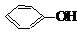 +NaOH→ +NaOH→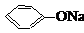 +H2O +H2O | B. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | ||
| C. | CH2=CH2+H2O→CH3CH2OH | D. | CH4+Cl2→CH2Cl2+H2 |