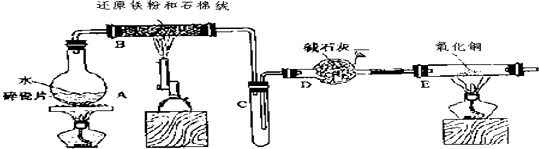
题目内容
【题目】按要求用化学用语回答下列问题:
(1)除去混入Fe2O3粉末中少量Al2O3杂质的试是 , 离子方程式为 .
(2)在呼吸面具中,Na2O2起反应的化学方程式为 .
(3)镁带着火时,不能用液态CO2灭火剂来灭火的原因是 . (用化学方程式表示).
(4)氯气用于漂白、消毒时,能起漂白、消毒作用的物质是(写化学式).
某研究性学习小组对漂白液进行了如下实验探究:取漂白液少量,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,可以证明漂白液具有的性质有 .
【答案】
(1)NaOH溶液;Al2O3+2OH﹣=2AlO2﹣+H2O
(2)2Na2O2+2CO2═2Na2CO3+O2
(3)2Mg+CO2 ![]() 2MgO+C
2MgO+C
(4)HClO;碱性、氧化性
【解析】解:(1)氧化铝与NaOH溶液反应,氧化铁难溶于水且不能与NaOH溶液反应,所以除去Fe2O3中混有的Al2O3杂质的试剂是NaOH溶液,发生的离子反应为Al2O3+2OH﹣=2AlO2﹣+H2O,
所以答案是:NaOH溶液;Al2O3+2OH﹣=2AlO2﹣+H2O;(2)过氧化钠和二氧化碳反应生成碳酸钠和氧气,方程式为:2Na2O2+2CO2=2Na2CO3+O2 ,
所以答案是:2Na2O2+2CO2═2Na2CO3+O2;(3)镁带着火时,不能用液态CO2灭火剂来灭火,原因是镁带能在CO2中燃烧,生成氧化镁和碳,反应:2Mg+CO2 ![]() 2MgO+C,
2MgO+C,
所以答案是:2Mg+CO2 ![]() 2MgO+C;(4)氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2OH++Cl﹣+HClO,取漂白液少量,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,说明溶液呈碱性,原因是次氯酸钠为强碱弱酸盐,水解呈碱性,水解生成的HClO具有强氧化性,具有漂白作用,
2MgO+C;(4)氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2OH++Cl﹣+HClO,取漂白液少量,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,说明溶液呈碱性,原因是次氯酸钠为强碱弱酸盐,水解呈碱性,水解生成的HClO具有强氧化性,具有漂白作用,
所以答案是:HClO;碱性、氧化性.

【题目】根据所学知识回答下列问题
(1)以K、Na、H、O、S、N中任两种或三种元素组成合适物质,分别填在表中②、④、⑥后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_______ | ③NaOH ④_______ | ⑤Na2SO4 ⑥_______ | ⑦CO2 ⑧SO3 | ⑨NH3 |
(2)写出①与少量的③溶液反应的离子方程式__________________________。
(3)写出铁与①溶液反应的化学方程式________________________________。
(4)某同学欲用10mol·L-1浓硫酸配制480 mL 1 mol·L-1的稀硫酸。配制480mL 1mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为_________mL。