题目内容
【题目】下列有关说法不正确的是( )
A. 将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性
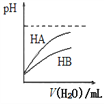
B. 如图表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则HB是强酸
C. 25℃时,pH=2的1.0 L醋酸溶液中水电离出的H+的数目为10-12NA
D. 某吸热反应能自发进行,则该反应一定是熵增的反应
【答案】B
【解析】A选项,pH=11的NaOH溶液浓度也为10﹣3mol/L,与醋酸浓度相同,等体积混合后,恰好完全反应生成醋酸钠,强碱弱酸盐,溶液显碱性,故A正确;B选项,稀释等pH的两种酸,稀释相同倍数时,pH变化越快的酸酸性越强,由图可知,稀释相同的倍数,HA的pH变化快,所以HA的酸性比HB强,HB应该是弱酸,B错误;C选项,常温下,pH=2的醋酸溶液中,H+总浓度等于0.01mol/L,根据Kw=c(H+)×c(OH-)=10-14(常温),c(OH-)=10﹣12molL﹣1,又因为醋酸溶液中OH-全部来自于水的电离,且水电离出的H+浓度等于OH-离子浓度,所以水电离出的H+浓度为10﹣12molL﹣1,体积为1 L时,物质的量为10-12mol,数目为10-12NA,C正确;根据△G=△H﹣T△S,吸热反应△H>0,则只有△S>0,才能使△G<0,吸热反应能自发进行,则该反应一定是熵增的反应,故D正确。故选B。

练习册系列答案
相关题目
【题目】已知X、Y、Z三种短周期元素在周期表中的位置如图所示,设X的原子序数为a。则下列说法正确的是
Y | ||
X | ||
Z |
A.Y是非金属性最强的元素
B.Z是金属元素
C.Y的原子序数为a-7
D.X的气态氢化物化学式为H2X