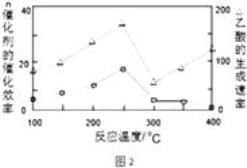
��Ŀ����
����Ŀ����֪X��Y��Z��WΪԭ���������������ֶ�����Ԫ�أ�����Y��ZΪ����Ԫ�ء�X��Y��Z��W������������Ӧ��ˮ����ס��ҡ�������֮�������ͼ��ʾ��Ӧ��ϵ(��ϵͼ�С��������������������ܷ�����Ӧ���������ж���ȷ����
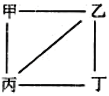
A. X��Ԫ�����ڱ��зǽ�������ǿ��Ԫ�� B. Zλ��Ԫ�����ڱ���3����IA��
C. ����ԭ���У�Yԭ�Ӱ뾶��С D. W�ļ������ӿ��ܴٽ�ˮ�ĵ���
���𰸡�D
��������Y��ZΪ����Ԫ�أ�������������ˮ�������ҡ������Һͱ�֮���ܷ�����Ӧ��˵��Ӧ��NaOH��Al(OH)3�ķ�Ӧ�����ݷ�Ӧ�����Լ�ԭ���������������Y��Na��ZΪAl��XΪN����ΪNaOH����ΪAl(OH)3����ΪHNO3�� ��������S��������Cl�� A�����ڱ��ǽ�������ǿ��F��Fû��������ۣ�û�к����ᣬ��A����B��Alλ�����ڱ���������IIIA�壬��B����C�� 4��ԭ�ӣ��뾶��С����N��ֻ��2�����Ӳ㣬�������������Ӳ㣬��C����D��W������S��Ҳ������Cl�������WΪS�������������S2��������S2����H2O ![]() HS����H2O���ٽ�ˮ�ĵ��룬��D��ȷ��
HS����H2O���ٽ�ˮ�ĵ��룬��D��ȷ��

��ϰ��ϵ�д�
�����Ŀ