题目内容
【题目】氮的重要化合物如氨(NH3)、氮氧化物(NxOx)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1)①NH3催化氧化可制备硝酸。
4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH1=-907.28 kJ·mol-1
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH2=-1269.02 kJ·mol-1
则4NH3(g)+6NO(g)===5N2(g)+6H2O(g) ΔH3=________________。
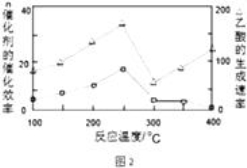
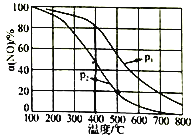
②NO被O2氧化为NO2。其他条件不变时,NO的转化率[α(NO)]与温度、压强的关系如下图所示。则p1________p2(填“>”“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是______________________________。
③在500℃温度时,2L密闭容器中充入2molNO和1molO2,达平衡时压强为P2MPa。则500℃时该反应的平衡常数Kp=_____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如下图所示。电极b的电极反应式为_________________,消耗标准状况下4.48LNH3时,被消除的NO2的物质的量为____________mol。
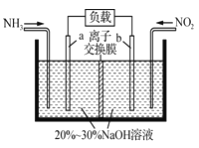
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如下图所示。
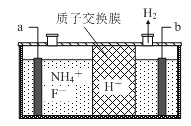
①a电极为电解池的_____________(填“阴”或“阳”)极,写出该电极的电极反应式:_____________;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_____________________。
②已知氨水电离常数Kb=1.8×10-5,氢氟酸电离常数Ka=3.5×10-4,则NH4F的电子式为_____________,0.1mol/LNH4F溶液中所有离子浓度由大到小的顺序为_____________________________。
【答案】 -1811.63 kJ·mol-1 > NO2几乎完全分解 7/32P2 MPa-1 2NO2+8e-+4H2O===8OH-+N2 0.15 阳 NH4++3F--6e-=NF3+4H+ F2 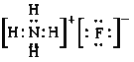 c(F-)> c(NH4+)> c(H+)> c(OH-)
c(F-)> c(NH4+)> c(H+)> c(OH-)
【解析】(1)①i.4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJmol-1;ii.4NH3(g)+3O2(g) ═2N2(g) +6H2O(g) △H2=-1269.02kJmol-1;目标反应的反应热为: ![]() =1811.63kJmol-1,故答案为:=-1811.63kJmol-1;
=1811.63kJmol-1,故答案为:=-1811.63kJmol-1;
②温度相同时p1的一氧化氮的转化率大,所以增大压强平衡正向移动,所以p1>p2;NO被O2氧化为NO2,方程式为:2NO+O2![]() 2NO2;α(NO)几乎为0表示无二氧化氮,说明NO2几乎完全分解,故答案为:>;NO2几乎完全分解;
2NO2;α(NO)几乎为0表示无二氧化氮,说明NO2几乎完全分解,故答案为:>;NO2几乎完全分解;
③500℃温度时,达平衡时压强为P2MPa,α(NO)=0.2,
2NO + O2![]() 2NO2
2NO2
起始(mol) 2 1 0
反应(mol) 0.4 0.2 0.4
平衡(mol) 1.6 0.8 0.4
平衡分压(MPa) ![]() P2
P2 ![]() P2
P2 ![]() P2
P2
平衡常数Kp= =
=![]() ,故答案为:
,故答案为: ![]() ;
;
(2)配平后的方程式为6NO2+8NH3=7N2+12H2O。电极b的电极发生还原反应,二氧化氮转化生成氮气,电极反应式为2NO2+8e-+4H2O═8OH-+N2;标准状况下4.48LNH3的物质的量为:0.2mol,根据4NH3~3NO2,所以被消除的NO2的物质的量为![]() ×0.2mol=0.15mol,故答案为:2NO2+8e-+4H2O═8OH-+N2;0.15;
×0.2mol=0.15mol,故答案为:2NO2+8e-+4H2O═8OH-+N2;0.15;
(3)①由图2可知,H+在b极上得到电子生成氢气,故b为阴极,那么a为阳极,阳极上NH4+失去电子生成NF3,电极反应方程式为:NH4++3F--6e-=NF3+4H+,依据电解原理可知,F-也可能失去电子生成氟单质,故氧化性较强的单质为氟气,故答案为:阳;NH4++3F--6e-=NF3+4H+;F2;
②NH4F属于离子化合物,电子式为 ,氨水电离常数Kb=1.8×10-5,氢氟酸电离常数Ka=3.5×10-4,说明HF的电离程度大于NH3H2O,则NH4F溶液中NH4+水解程度大于F-,溶液显酸性,离子浓度由大到小的顺序为c(F-)> c(NH4+)> c(H+)> c(OH-),故答案为:
,氨水电离常数Kb=1.8×10-5,氢氟酸电离常数Ka=3.5×10-4,说明HF的电离程度大于NH3H2O,则NH4F溶液中NH4+水解程度大于F-,溶液显酸性,离子浓度由大到小的顺序为c(F-)> c(NH4+)> c(H+)> c(OH-),故答案为: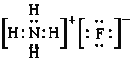 ;c(F-)> c(NH4+)> c(H+)> c(OH-)。
;c(F-)> c(NH4+)> c(H+)> c(OH-)。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案