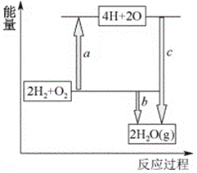
��Ŀ����
����Ŀ��ij��ѧ��ȤС����100mL 1mol/L NaOH��Һ��ȫ������a mol CO2��õ���ҺA��Һ������ޱ仯����Ϊ��ȷ����ҺA�����ʳɷּ�aֵ������ȤС���ͬѧ����������ʵ�飮������������������Ӧʵ�����ݣ�
��1��[�������] �������ҺA������ΪNaOH��Na2CO3��
�������ҺA������ΪNa2CO3��
�������ҺA������ΪNa2CO3��NaHCO3��
���������ҺA������Ϊ ��
��2��[ʵ�����] ��i����ͬѧȡ������ҺA���Թܣ������Թ��еμӼ��η�̪��Һ����ҺA��죬�ɴ˵ó�����I������
��ii����ͬѧ��������Ϊ��ͬѧ��ʵ����������������ӷ���ʽ˵����ͬѧ���ж�����������һ�������Ӧ��ȡ������Һ�������м�����������Һ����������ҺA�Ƿ� �� ������������Һ��۲쵽��ҺA����ǣ�
��iii����ͬѧΪ�˼�����ҺA�Ƿ��������ʣ�������ͬѧ���û�����Һ���й��ˣ�������Һ��Ϊ���ݣ������е�һ�ݼ���ϡ���ᣬ����ɫ�������ɣ��������ȷ��
��iv��Ϊȷ�ⶨaֵ����ͬѧȡ��10mL ��ҺA����ƿ�У��õζ��������м���ijŨ�ȵ�ϡ���ᣬ��¼���������������������������������Ƴ���ͼ����a= �� ������������ʵ���Ũ��Ϊ �� 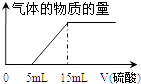
���𰸡�
��1��Na2CO3
��2��CO32��+H2O?HCO3��+OH�� ��HCO3��+H2O?H2CO3+OH����BaCl2��Na2CO3����![]() mol��
mol��![]()
���������⣺��100mL 1mol/L NaOH��Һ��ȫ������a mol CO2��õ���ҺA��Һ������ޱ仯����������̼������������Һ��Ӧ����̼���ƣ���Һ��Ϊ�������ƺ�̼���ƣ�������̼ǡ�ú�����������Һ��Ӧ����̼���ƣ�������̼���˵õ���Һ������Ϊ̼���ƺ�̼�����ƣ�������̼������Ӧ����̼�����ƣ���1���������ҺA������ΪNaOH��Na2CO3���������ҺA������ΪNa2CO3���������ҺA������ΪNa2CO3��NaHCO3�����������ҺA������ΪNaHCO3�����Դ��ǣ�NaHCO3����2����ii����ͬѧȡ������ҺA���Թܣ������Թ��еμӼ��η�̪��Һ����ҺA��죬��Һ�ʼ��ԣ����ܵ�ԭ���Ǽ���������������̼������Һ��̼������ӡ�̼���������ˮ����Һ�Լ��ԣ������ӷ���ʽ˵����ͬѧ���ж�����Ϊ��CO32��+H2OHCO3��+OH�� ��HCO3��+H2OH2CO3+OH��������һ�������Ӧ��ȡ������Һ�������м����������Ȼ�����Һ���۲쵽��ҺA�������Ϊ�˼�����ҺA�к���̼���ƣ����Դ��ǣ�CO32��+H2OHCO3��+OH�� ��HCO3��+H2OH2CO3+OH����BaCl2��Na2CO3����iii����ͬѧ���û�����Һ���й��ˣ�������Һ��Ϊ���ݣ������е�һ�ݼ���ϡ���ᣬ����ɫ�������ɣ���̼��������Һ�����ᷴӦ���ɶ�����̼���壬����̼���ƺ�̼�����ƣ��������ȷ�����Դ��ǣ���iv��ͼ�������֪��ʼ������������5mL�����ɶ�����̼������������Ϊ10mL��֤����������Ϊ�����ʵ�����̼���ƺ�̼�����ƣ����ݻ�ѧ����ʽ������ϵ����õ���������Ũ��Ϊ��cmol/L��������ӦΪ��2Na2CO3+H2SO4=2NaHCO3+Na2SO4 �� 2NaHCO3+H2SO4=Na2SO4+2CO2��+2H2O�� ����Ԫ���غ���ʽ���㣺100mL 1mol/L NaOH��Һn��NaOH��=0.1mol��ȡ10mL��Һ�к��������������ʵ���Ϊ0.01mol������Ũ��Ϊc��
�õ�0.015L��c��2=0.01mol
c= ![]() mol/L������ͼ���֪NaHCO3��������10mL��
mol/L������ͼ���֪NaHCO3��������10mL��
2NaHCO3+ | H2SO4 | = | Na2SO4+ | 2CO2��+ | 2H2O |
2 | 1 | ||||
n | ��0.015L��0.005L���� |
n= ![]() mol
mol
100mL��Һ������̼�غ�õ�������̼���ʵ���a= ![]() mol��10=
mol��10= ![]() mol��
mol��
���Դ��ǣ� ![]() mol��
mol�� ![]() mol/L��
mol/L��