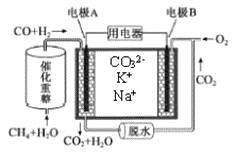
��Ŀ����
����Ŀ����֪A��B��C��D��E��X����ѧ���������������ͼת����ϵ������������ͷ�Ӧ������ȥ���� 
��1����AΪ�����Ľ������ʣ���ɫ��Ӧ�ʻ�ɫ��X��ʹƷ����Һ��ɫ��д��E�к��еĻ�ѧ����������֪1molA��ˮ��Ӧ�ų�283.5kJ����������д��A��ˮ��Ӧ���Ȼ�ѧ��Ӧ����ʽ��
��2����A Ϊ������Ԫ����ɵĵ��ʣ���Ԫ�ص�����������ˮ����������ǿ������A��H2O��Ӧ�����ӷ���ʽ ��
��3����A Ϊ����ɫ��ĩ���ش��������⣺ ��1molA��������H2O��ַ�Ӧʱ��ת�Ƶ�������Ϊ
����XΪ�ǽ������ʣ�ͨ��Ϊ��ɫ��ĩ��д��D�Ľṹʽ
��4����AΪ�����X��Fe����ҺD����KSCN��Һ��죮 ��A��H2O��Ӧ�����ӷ���ʽ
���������ӷ���ʽ��ʾD�εľ�ˮԭ�� ��
���𰸡�
��1�����Ӽ����ۼ���2Na��s��+2H2O��l��=2NaOH��aq��+H2��g����H=��567kJ/mol
��2��Cl2+H2O?H++Cl��+HClO
��3��6.02��1023��O=C=O
��4��3NO2+H2O=2H++2NO3��+NO��Fe3++3H2O=Fe��OH��3�����壩+3H+
���������⣺��1����AΪ�����Ľ������ʣ���ɫ��Ӧ�ʻ�ɫ��ӦΪNa��X��ʹƷ����Һ��ɫ��ӦΪSO2 �� ��BΪH2 �� CΪNaOH��DΪNa2SO3 �� EΪNaHSO3 �� E�к��еĻ�ѧ������Ϊ���Ӽ����ۼ�����֪1molNa��ˮ��Ӧ�ų�283.5kJ����������Na��ˮ��Ӧ���Ȼ�ѧ��Ӧ����ʽΪ2Na��s��+2H2O��l��=2NaOH��aq��+H2��g����H=��567kJ/mol�����Դ��ǣ����Ӽ����ۼ���2Na��s��+2H2O��l��=2NaOH��aq��+H2��g����H=��567kJ/mol����2����AΪ������Ԫ����ɵĵ��ʣ���Ԫ�ص�����������ˮ����������ǿ��ӦΪCl2 �� ��BΪHClO��CΪHCl����Cl2��H2O��Ӧ�����ӷ���ʽΪCl2+H2OH++Cl��+HClO�����Դ��ǣ�Cl2+H2OH++Cl��+HClO����3����AΪ����ɫ��ĩ��ӦΪNa2O2 �� XΪ�ǽ������ʣ�ͨ��Ϊ��ɫ��ĩ����XΪC������ת����ϵ��֪BΪ�������ơ�CΪ������DΪ������̼��EΪһ����̼����A��ˮ��Ӧ����ʽΪ2Na2O2+2H2O=4NaOH+O2�����÷�Ӧ�й����������������ͻ�ԭ�����÷�Ӧ��ת�Ƶĵ�����ĿΪ2����1molA��������H2O��ַ�Ӧʱ��ת�Ƶ�������Ϊ 6.02��1023 �� ���Դ��ǣ�6.02��1023����DΪ������̼����D�ĽṹʽΪO=C=O�����Դ��ǣ�O=C=O����4����AΪ�����X��Fe����ҺD����KSCN��Һ��죬��D�к��������ӣ���ת����ϵ��֪C����ǿ�����ԣ���AΪNO2 �� BΪNO��CΪHNO3 �� DΪ Fe��NO3��3 �� EΪ Fe��NO3��2 �� ��NO2��H2O��Ӧ�����ӷ���ʽΪ3NO2+H2O=2 H++2NO3��+NO�����Դ��ǣ�3NO2+H2O=2 H++2NO3��+NO����DΪ Fe��NO3��3 �� ������ˮ�����������������壬�ܾ�ˮ����Ӧ�����ӷ���ʽΪFe3++3H2O=Fe��OH��3 �����壩+3 H+ �� ���Դ��ǣ�Fe3++3H2O=Fe��OH��3 �����壩+3 H+ ��