题目内容
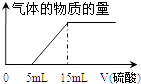
【题目】一定质量的镁、铝混合物投到2molL﹣1的盐酸中,待金属完全溶解后,向溶液中加入2molL﹣1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则: 
(1))80~90mL对应反应的离子方程式 .
(2)金属铝的质量为
(3)盐酸的体积是mL.
(4)a的取值范围是 .
(5)n(Mg)/n(Al)的最大值是 .
【答案】
(1)Al(OH)3+OH﹣=AlO2﹣+2H2O
(2)0.54g
(3)80
(4)0≤a<50
(5)2.5
【解析】解:0~a段没有生成沉淀,说明盐酸过量,加入的氢氧化钠与氯化氢反应;a~80段开始生成沉淀,加入80mL氢氧化钠溶液后沉淀达到最大量,此时溶液中的溶质为NaCl;80~90段氢氧化铝开始溶解,溶解氢氧化铝消耗了10mLNaOH,则氢氧化铝沉淀的物质的量为:2mol/L×0.01L=0.02mol;当加入90mLNaOH溶液后氢氧化铝完全溶解,此时沉淀只有氢氧化镁,(1)根据分析可知,80~90mL对应反应的离子方程式:Al(OH)3+OH﹣=AlO2﹣+2H2O,所以答案是:Al(OH)3+OH﹣=AlO2﹣+2H2O;(2)从横坐标80mL到90mL这段可以得出:n(Al(OH)3)=0.02mol,则n(Al)=n(Al(OH)3)=0.02mol,原混合物中铝的质量为:27g/mol×0.02mol=0.54g,所以答案是:0.54;(3)加入80mL氢氧化钠溶液时,溶质为NaCl,则:n(HCl)=n(NaOH)=2mol/L×0.08L=0.16mol,盐酸的体积为: ![]() =0.08L=80mL,所以答案是:80;(4)假设盐酸溶解金属后没有剩余,此时酸恰好与合金反应完全,即a=0,通过极值法,当合金中完全是铝时,因为沉淀Al3+需要消耗NaOH溶液的体积为30mL,从图可知,中和过量的酸所消耗的碱液体积最大为50mL,但是假设不成立,最大值是不存在的,所以的取值范围为 0≤a<50,所以答案是:0≤a<50;(5)n(Al)=n(Al(OH)3)=2molL﹣1×0.01L=0.02mol,所以沉淀Al3+需要消耗的OH﹣为0.06mol,即NaOH溶液的体积为30mL,镁离子和铝离子沉淀完全消耗的碱的体积为(80﹣a)mL,若假设盐酸没有剩余,所以沉淀Mg2+需要NaOH溶液的体积最大值为:80mL﹣30mL=50mL,n(Mg)的最大值为:
=0.08L=80mL,所以答案是:80;(4)假设盐酸溶解金属后没有剩余,此时酸恰好与合金反应完全,即a=0,通过极值法,当合金中完全是铝时,因为沉淀Al3+需要消耗NaOH溶液的体积为30mL,从图可知,中和过量的酸所消耗的碱液体积最大为50mL,但是假设不成立,最大值是不存在的,所以的取值范围为 0≤a<50,所以答案是:0≤a<50;(5)n(Al)=n(Al(OH)3)=2molL﹣1×0.01L=0.02mol,所以沉淀Al3+需要消耗的OH﹣为0.06mol,即NaOH溶液的体积为30mL,镁离子和铝离子沉淀完全消耗的碱的体积为(80﹣a)mL,若假设盐酸没有剩余,所以沉淀Mg2+需要NaOH溶液的体积最大值为:80mL﹣30mL=50mL,n(Mg)的最大值为: ![]() =0.05mol,所以该合金中镁铝两元素物质的量之比的最大值为:0.05mol:0.02mol=2.5,所以答案是:2.5.
=0.05mol,所以该合金中镁铝两元素物质的量之比的最大值为:0.05mol:0.02mol=2.5,所以答案是:2.5.