题目内容
【题目】锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时电极反应式为负极反应:C6Li-xe-==C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)正极反应:Li1-xMO2+xLi++xe-==LiMO2(LiMO2表示含锂的过渡金属氧化物)
(1)锂电池放电时电池的反应式为_____________________________。
(2)该电池工作时,Li+向________(填“正极”或“负极”)迁移。
(3)假设放电过程中消耗负极材料5.6g,则转移的电子数目为_______(NA为阿伏加德罗常数的值)。
科学家设想利用太阳能电池电解水产生的气体制成燃料电池给卫星充电,可建立环保型的卫星供电系统。
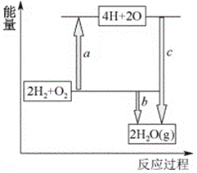
(4)已知破坏1molH-H键、1molO=O键、1molH-O键时分别需要吸收436kJ、498kJ、465kJ的能量。下图表示H2、O2转化为水的反应过程能量变化,则b=______。
(5)若该氢氧燃料电池的电解质溶液为酸性溶液,电池总反应为2H2+O2=2H2O。该电池的正极反应为________________________________。
【答案】 C6Li+Li1-XMO2==LiMO2+C6Li1-x 正极 0.8NA 490KJ O2+4e- + 4H+ ==2H2O
【解析】(1)正负极反应式叠加即得到锂电池放电时电池的反应式为C6Li+Li1-XMO2=LiMO2+C6Li1-x;(2)原电池中阳离子向正极移动,则该电池工作时,Li+向正极迁移;(3)1mol锂失去1mol电子,假设放电过程中消耗负极材料5.6g,锂的物质的量是5.6g÷7g/mol=0.8mol,则转移的电子数目为0.8NA;(4)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则根据示意图可知b=4×465 kJ-2×436 kJ-498 kJ=490 kJ;(5)正极发生得到电子的还原反应,即氧气在正极通入,由于电解质溶液显酸性,则该电池的正极反应为O2+4e-+4H+=2H2O。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案