题目内容
12.下列表达式正确的是( )| A. | 碳原子的L层电子轨道表示式: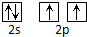 | |
| B. | 氯化氢的电子式: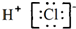 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p4 | |
| D. | 碳-12原子:${\;}_{6}^{12}$C |
分析 A.电子总是先单独占据一个轨道,且自旋相同,P轨道有3个;
B.氯化氢是共价化合物;
C.硫离子核外18电子;
D.元素符号的左上角数字是质量数,左下角数字为质子数.
解答 解:A.碳原子的L层有4个电子,电子轨道表示式: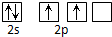 ,故A错误;
,故A错误;
B.氯化氢是共价化合物,所以其电子式为 ,故B错误;
,故B错误;
C.硫离子核外18电子,核外电子排布式为1s22s22p63s23p6,故C错误;
D.碳元素的质子数是6,质量数为12,该原子为:${\;}_{6}^{12}$C,故D正确;
故选D.
点评 本题考查化学用语,涉及电子轨道表示式、电子式、核外电子排布式和核素等,侧重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
2.某芳香烃的分子式为C9H12,其苯环上一氯代物只有两种同分异构体有几种( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
3.关于化学反应中的能量变化,下列说法中不正确的是( )
| A. | 化学反应中的能量变化,主要是由化学键的变化引起的 | |
| B. | 对于可逆反应:aA(g)+bB(g)═bC(g)+dD(g),如果正反应是放热反应,逆反应一定是吸热反应 | |
| C. | 氢气燃烧生成水是一个放热反应,说明1mol H2的能量高于1mol H2O的能量 | |
| D. | 加热才能发生的反应,不一定是吸热反应 |
20. 是一种有机烯醚,可以用烃A通过下列路线制得
是一种有机烯醚,可以用烃A通过下列路线制得

则下列说法正确的是( )
 是一种有机烯醚,可以用烃A通过下列路线制得
是一种有机烯醚,可以用烃A通过下列路线制得
则下列说法正确的是( )
| A. | 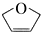 的分子式为C4H4O 的分子式为C4H4O | |
| B. | A的结构简式是CH2=CHCH2CH3 | |
| C. | A能使高锰酸钾酸性溶液褪色 | |
| D. | ①、②、③的反应类型分别为卤代、水解、消去 |
7.下列推断正确的是( )
| A. | BF3是三角锥形分子 | |
| B. | NH4+的电子式: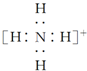 ,离子呈平面形结构 ,离子呈平面形结构 | |
| C. | CH4分子中的4个C-H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键 | |
| D. | CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-H σ键D |
17.下列各组物质中,所含化学键类型和晶体类型都相同的是( )
| A. | NaF、HNO3 | B. | Na2O、H2O | C. | HCl、MgF2 | D. | CO2、CH4 |
4.2013年6月11日,我国“神十”载人航天飞船发射取得圆满成功.火箭发射时燃料燃烧的反应为:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(l)△H=akJ/mol,关于此反应的下列说法中正确的是( )
| A. | a>0 | |
| B. | 每生成1mol水,转移8mol电子 | |
| C. | 氧化产物与还原产物的质量比为2:1 | |
| D. | N2H4是氧化剂 |
1.已知白磷(P4)与CuSO4溶液反应的化学方程式为(Cu3P中P的化合价为-3价):11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4,则2molCuSO4能氧化白磷的物质的量是( )
| A. | $\frac{1}{20}$mol | B. | $\frac{1}{10}$mol | C. | $\frac{1}{5}$mol | D. | $\frac{2}{5}$mol |
2.下列分子中存在π键的是( )
| A. | PCl3 | B. | HCl | C. | H2 | D. | N2 |