题目内容
【题目】25℃时,向20 mL 0.01 mol·L-1HA(aq)中不断滴入0.02 mol·L-1 NaOH(aq),混合溶液pH变化如图所示。此过程溶液下列说法不正确的是(已知:25℃时一元酸HA(aq)电离平衡常数Ka=1.6×10-5)
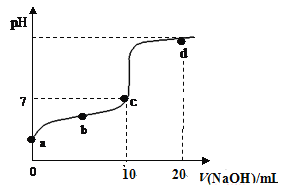
A. a点溶液的pH大于3
B. b点溶液中离子:c(A-)>c(Na+)>c(H+)>c(OH-)
C. c点表示酸HA(aq)和NaOH(aq)溶液恰好完全反应
D. d点溶液加水稀释后c(H+)/c(HA)的值会增大
【答案】C
【解析】
A、a点时,为0.01 mol·L-1HA溶液,根据电离常数计算c(H+);
B、b点溶液为HA和NaA的混合物,溶液呈酸性;
C、根据反应方程式,结合溶液呈中性进行判断;
D、d点溶液存在A-的水解平衡,在一定温度下水解平衡常数不变,据此分析。
A、a点时,为0.01 mol·L-1HA溶液,已知25℃时一元酸HA(aq)电离平衡常数Ka=1.6×10-5,
HA![]() H++A-
H++A-
起始浓度(mol/L) 0.01 0 0
平衡浓度(mol/L) 0.01-x x x
![]() =1.6
=1.6![]() 10-5,由于x很小,0.01-x
10-5,由于x很小,0.01-x![]() 0.01,则x2=1.6
0.01,则x2=1.6![]() 10-7,解得x=4
10-7,解得x=4![]() 10-4,pH=-lg4
10-4,pH=-lg4![]() 10-4=4-2lg2=4-2
10-4=4-2lg2=4-2![]() 0.3=3.4>3,故A正确;
0.3=3.4>3,故A正确;
B、b点时酸过量,溶液为HA和NaA的混合物,溶液呈酸性,应存在c(A-)>c(Na+)>c(H+)>c(OH-),故B正确;
C、若酸HA(aq)和NaOH(aq)溶液恰好完全反应则生成NaA为强碱弱酸盐,水解显碱性,pH>7,与c点溶液呈中性不符,故C错误;
D、d点为NaOH和NaA的混合物,溶液中存在醋酸根离子的水解平衡:A -+H2O![]() HA+OH-,水解常数Kh=
HA+OH-,水解常数Kh=![]() =
=![]() ,在一定温度下不变,加水稀释后,c(A-)减小,则c(HA) /c(H+)减小,故c(H+)/c(HA)的值增大,故D正确;
,在一定温度下不变,加水稀释后,c(A-)减小,则c(HA) /c(H+)减小,故c(H+)/c(HA)的值增大,故D正确;
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】t℃时,将3 mol A和2 mol B气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) ![]() 2C(g),2 min时反应达到平衡状态(温度不变),测得C的浓度为0.2 mol/L,请填写下列空白:
2C(g),2 min时反应达到平衡状态(温度不变),测得C的浓度为0.2 mol/L,请填写下列空白:
(1)该过程用A表示的反应速率为:v(A)=_______;该温度下该反应的化学平衡常数表达式为__________。
(2)比较达到平衡时,A、B两反应物的转化率:α(A)______α(B)(填“>”、“=”或“<”)。
(3)判断反应达到平衡状态的依据是(填字母序号)__________。
a.生成C的速率与消耗B的速率相等 b.混合气体的密度不变
c.混合气体的相对平均分子质量不变 d.A的质量分数不再发生变化
(4)若升高温度,再次达平衡时,平衡常数数值变大,则该反应的![]() H_____0(填“>”、“=”或“<”)。
H_____0(填“>”、“=”或“<”)。
(5)若保持温度不变时,继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,则化学反应速率会__________(填“加快”、“减慢”或“不变”),化学平衡将_________(填“正反应方向移动”、“逆反应方向移动”或“不移动”)。
(6)在恒温恒容密闭容器中进行上述反应,起始投料时各物质的浓度如下表:
A | B | C | |
投料I | 3.0 mol/L | 1.0 mol/L | 0 |
投料II | 2.0 mol/L | 1.0 mol/L | 2.0 mol/L |
按投料I进行反应,测得达到化学平衡状态时A的转化率为40%,若按投料II进行反应,起始时反应进行的方向为________(填“正向”、“逆向”或“不移动)。