题目内容
【题目】游离态氮称为惰性氮,游离态氮转化为化合态氮称之为氮的活化,在氮的循环系统中,氮的过量“活化”,则活化氮开始向大气和水体过量迁移,氮的循环平衡被打破,导致全球环境问题。
Ⅰ. 氮的活化
工业合成氨是氮的活化重要途径之一,在一定条件下,将N2 和 H2 通入到体积为0.5L的恒容容器中,反应过程中各物质的物质的量变化如图所示:

(1)10min内用NH3表示该反应的平均速率,v(NH3)=____________。
(2)在第10min和第25min改变的条件可能分别是_________、________(填字母)。
A.加了催化剂 B. 升高温度 C. 增加NH3的物质的量
D.压缩体积 E.分离出氨气
(3)下列说法能说明该可逆反应达到平衡状态的是__________(填字母)。
A. 容器中气体密度不变 B. 容器中压强不变
C. 3v(H2)正=2v(NH3)逆 D. N2、H2、NH3分子数之比为1∶3∶2
Ⅱ.催化转化为惰性氮 已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
(4)在250C、101KPa时,N2(g)+3H2(g) ![]() 2NH3(g) △H1= -92.4kJ/mol.
2NH3(g) △H1= -92.4kJ/mol.
2H2(g)+O2(g)=2H2O(l) △H2= -571.6 kJ/mol
N2(g)+O2(g)=2NO(g) △H3= +180kJ/mol
则NO与NH3反应生成惰性氮的热化学方程式______________________________。
(5)在有氧条件下,新型催化剂M能催化CO与NOx反应生成N2。现向某密闭容器中充入等物质的量浓度的NO2和CO气体,维持恒温恒容,在催化剂作用下发生反应:
4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H<0,相关数据如下:
N2(g)+4CO2(g) △H<0,相关数据如下:
0min | 5min | 10min | 15min | 20min | |
c(NO2) /mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2) /mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①计算此温度下的化学平衡常数K=______,
②实验室模拟电解法吸收NOx装置如图,(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验(a<b),电解时NO2发生反应的电极反应式:_________________________________。

【答案】0.02mol·L-1·min-1 A E B 6NO(g)+4NH3(g)=5 N2(g)+6H2O(l) △H=-2070 kJ·mol-1 1/9(或0.11)(mol·L-1)-1 H2O+NO2-e- = NO3-+2H+
【解析】
(1)10min内氨气的物质的量增加为0.10 mol,根据反应速率![]() =
= ![]() =
= ![]() 计算;
计算;
(2)根据图象知,平衡向正反应方向移动,10 min时是连续的,三种气体物质的速率增加倍数相同,说明为使用催化剂;25 min时,瞬间氨气的物质的量减小,据此分析作答;
(3)可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
(4)NH3脱除NO的化学方程式为4NH3(g)+6NO(g)═5N2(g)+6H2O(l),可结合盖斯定律计算反应热;
(5)①化学平衡常数K等于平衡时生成物浓度幂之积比上反应物浓度幂之积;
②根据图知,电解时,左室中电极上氢离子放电生成氢气,则左室为阴极室,右室为阳极室,阳极上通入的是氮氧化物,生成的硝酸,所以阳极上氮氧化物失电子生成硝酸;
(1)根据图象可知,10 min时氨气的物质的量为0.1 mol,则10 min内用NH3表示该反应的平均速率为:v(NH3) = ![]() = 0.02 mol/(Lmin),
= 0.02 mol/(Lmin),
故答案为:0.02 mol/(Lmin);
(2)由图象可知各组分物质的量变化增加,且10min时各物质的变化是连续的,20min达平衡时,△n (N2) = 0.025 mol × 4 = 0.1 mol,△n(H2) = 0.025 mol × 12 = 0.3 mol,△n(NH3) = 0.025 mol × 8 = 0.2 mol,根据物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10 min可能改变的条件是使用催化剂,故A项正确;
B. 升高温度,三种气体物质速率虽会成倍地增大,但根据热效应可知,正反应速率增大的相对慢,故B项错误;
C. 增加NH3物质的量,逆反应速率增加的倍数大,故C项错误;
D. 压缩体积,相当于增大压强,三种气体速率虽会增大,但增大的程度不相同,正反应速率比逆反应速率增大的快,与图像信息不符合,故D项错误;
E. 分离出氨气后,瞬间氨气的物质的量会下降,N2和H2不会改变,与图中10 min描述的状况不符,故E项错误;
故答案为A;
25 min时,瞬间NH3骤降,即NH3的浓度下降,N2和H2在第25 min时刻未变化,平衡向正反应方向移动,则可能的条件为分离出氨气,E项正确;
故答案为:E;
(3)A. 混合气体的质量不变,气体的体积不变,故密度不变,若密度不再随时间变化,不能说明平衡,故A项错误;
B. 容器内前后气体的物质的量有变化,说明压强是变量,总压强不再随时间而变化,说明达到平衡,故B项正确;
C. 3v(H2)正= 2v(NH3)逆,表示的是正反应和逆反应,但是不满足计量数关系,说明没有达到平衡状态,故C项错误;
D. N2、H2、NH3分子数之比为1∶3∶2,无法判断各组分的浓度是否不再变化,故D项错误;
故答案为:B;
(4)在250C、101KPa时,
①N2(g)+3H2(g) ![]() 2NH3(g) △H1= -92.4kJ/mol.
2NH3(g) △H1= -92.4kJ/mol.
②2H2(g)+O2(g)=2H2O(l) △H2= -571.6 kJ/mol
③N2(g)+O2(g)=2NO(g) △H3= +180kJ/mol
利用盖斯定律,将②×3①×2③×3可得6NO(g)+4NH3(g)=5 N2(g)+6H2O(l) △H=-2070 kJ·mol-1,
故答案为:6NO(g)+4NH3(g)=5 N2(g)+6H2O(l) △H=-2070 kJ·mol-1;
(5)①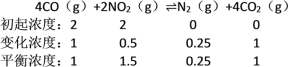
所以K =![]() = 1/9(0.11)(mol·L-1)-1
= 1/9(0.11)(mol·L-1)-1
故答案为:1/9(或0.11)(mol·L-1)-1;
②根据图知,电解时,左室中电极上氢离子放电生成氢气,则左室为阴极室,右室为阳极室,阳极上通入的是氮氧化物,生成的硝酸,所以阳极上氮氧化物失电子和水生成硝酸:H2O+NO2-e- = NO3-+2H+,
故答案为:H2O+NO2-e- = NO3-+2H+;


