题目内容
20.某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,设计如图原电池,盐桥中装有饱和溶液.下列说法正确的是( )
| A. | b电极上发生还原反应 | |
| B. | 外电路电子的流向是从a到b | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O |
分析 由2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,结合原电池中负极发生氧化反应,电流从正极流向负极,阴离子向负极移动来解答.
解答 解:A、b为负极,负极发生氧化反应,故A错误;
B、由上述分析可知,a为正极,电子由负极流向正极,即从b流向a,故B错误;
C、阴离子向负极移动,则盐桥中的SO42-移向乙烧杯中,故C错误;
D、甲烧杯中发生还原反应,Mn元素的化合价降低,电极反应为MnO4-+8H++5e-═Mn2++4H2O,故D正确;
故选D.
点评 本题考查原电池的工作原理及常见的化学电源,明确氧化还原反应中元素的化合价变化及原电池工作原理是解答本题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列物质的变化过程中,有共价键明显被破坏的是( )
| A. | I2升华 | B. | NaCl颗粒被粉碎 | ||
| C. | H2SO4溶于水得硫酸溶液 | D. | NaOH受热熔化 |
11.美国《Science》杂志曾经报道:在40GPa高压下,用激光器加热到1800K,人们成功制得了原子晶体干冰.有关原子晶体干冰的推断错误的是( )
| A. | 有很高的熔点和沸点 | B. | 易汽化,可用作制冷材料 | ||
| C. | 含有极性共价键 | D. | 硬度大,可用作耐磨材料 |
8.在含有0.6molCl-、0.8molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响).若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x.则( )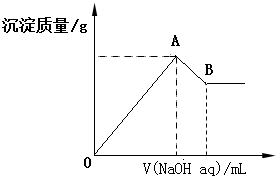

| A. | x=$\frac{2a}{5-a}$ | |
| B. | x的取值范围是0<x<$\frac{11}{32}$ | |
| C. | A点横坐标的值随x发生变化 | |
| D. | 若B点横坐标为200mL时,c(NaOH)=7.0mol/L |
15.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | CH2=CH2通入溴的四氯化碳溶液中 | 溶液褪色 | CH2=CH2发生取代反应 |
| B | KIO3溶液中加入HI溶液并加入淀粉 | 溶液变蓝色 | 氧化性:KIO3>I2 |
| C | 将盛满氯气的试管倒扣在水槽中,放在日光下静置一段时间 | 气体逐渐减少,最后变为无色 | Cl2置换出水中的氧生成了O2 |
| D | 将苯、溴水混合后加入大试管加热 | 试管底部产生油状物 | 苯发生取代反应生成溴苯 |
| A. | A | B. | B | C. | C | D. | D |
5.下列说法正确的是( )
| A. | 按系统命名法,有机物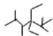 的名称是 2,2,4,5-四甲基-3,3-二乙基己烷 的名称是 2,2,4,5-四甲基-3,3-二乙基己烷 | |
| B. | 苯、甲苯、二甲苯互为同系物,均能使酸性高锰酸钾溶液褪色 | |
| C. | 等质量的苯、乙炔(CH≡CH)、乙烯和甲烷分别在氧气中充分燃烧,所消耗的氧气的量依次增加 | |
| D. | 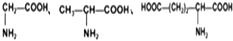 三种氨基酸之间脱水,最多可生成6种二肽 三种氨基酸之间脱水,最多可生成6种二肽 |
12.下列说法正确的是( )
| A. | 钠久置于空气中,可以和空气中的有关物质反应,最终生成NaHCO3 | |
| B. | 氮气的化学性质通常非常稳定,但在放电条件下可以与O2反应生成NO2 | |
| C. | 海水制食盐、石油分馏、焰色反应都属于物理变化 | |
| D. | 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 |
9.在下列实验中,应将温度计插入水浴中的是( )
| A. | 在实验室中蒸馏石油 | B. | 由苯制硝基苯 | ||
| C. | 由酒精制乙烯 | D. | 由乙酸与乙醇反应制乙酸乙酯 |
10.对于SO2和CO2的说法中正确的是( )
| A. | 都是直线形结构 | B. | 中心原子都采用SP杂化轨道 | ||
| C. | SO2为V形结构,CO2为直线形结构 | D. | S原子和C原子上都没有孤对电子 |