题目内容
10.对于SO2和CO2的说法中正确的是( )| A. | 都是直线形结构 | B. | 中心原子都采用SP杂化轨道 | ||
| C. | SO2为V形结构,CO2为直线形结构 | D. | S原子和C原子上都没有孤对电子 |
分析 A.先计算分子的价层电子对,再根据价层电子对互斥理论确定分子的空间结构;
B.先计算分子的价层电子对,再根据价层电子对互斥理论确定原子的杂化方式;
C.先计算分子的价层电子对,再根据价层电子对互斥理论确定分子的空间结构;
D.根据$\frac{1}{2}$(a-xb)计算中心原子的孤对电子个数.
解答 解:A.SO2的价层电子对个数=2+$\frac{1}{2}$(6-2×2)=3,含有1个孤电子对,该分子为V形结构,CO2的价层电子对个数=2+$\frac{1}{2}$(4-2×2)=2,该分子是直线形结构,故A错误;
B.SO2的价层电子对个数是3,所以硫原子采取sP2杂化,CO2的价层电子对个数是2,所以碳原子采取sP杂化,故B错误;
C.SO2的价层电子对个数=2+$\frac{1}{2}$(6-2×2)=3,该分子为V形结构,CO2的价层电子对个数=2+$\frac{1}{2}$(4-2×2)=2,该分子是直线形结构,故C正确;
D.SO2的孤电子对个数=$\frac{1}{2}$(6-2×2)=1,CO2的孤电子对个数=$\frac{1}{2}$(4-2×2)=0,所以二氧化硫有1对孤对电子,二氧化碳没有孤对电子,故D错误;
故选C.
点评 本题考查了原子的杂化方式、价层电子对互斥理论、分子的空间构型的判断等知识点,难度不大,注意原子的杂化方式的判断、分子空间构型的判断.

练习册系列答案
相关题目
20.某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,设计如图原电池,盐桥中装有饱和溶液.下列说法正确的是( )
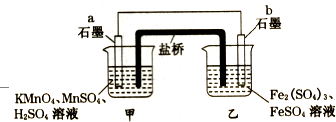

| A. | b电极上发生还原反应 | |
| B. | 外电路电子的流向是从a到b | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O |
1.下列装置能够组成原电池的是( )
| A. | 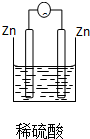 | B. | 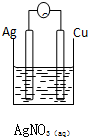 | C. | 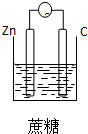 | D. | 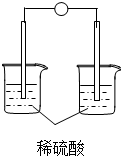 |
18.已知第3周期某元素R的气态氢化物的化学式为H2R,下列叙述中不正确的是( )
| A. | 该元素的原子最外电子层上有6个电子 | |
| B. | 该元素最高正价氧化物的化学式为RO2 | |
| C. | 该元素一定是非金属元素 | |
| D. | 该元素最高价氧化物的对应水化物的化学式为H2RO4 |
5.下列说法正确的是( )
| A. | 因为水分子间存在氢键,所有水分子较稳定 | |
| B. | 碘固体升华过程中吸收的热量用于克服碘原子间的作用力 | |
| C. | 溴化氢溶于水能电离出H+、Br-,所以溴化氢是离子化合物 | |
| D. | 纯碱和烧碱的熔化均破坏了离子键 |
15.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是( )
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| C. | [Cu(NH3)4]2+的空间构型为正四面体型 | |
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
2.对下列事实的解释错误的是( )
| A. | 在蔗糖中加入浓H2SO4后出现发黑现象,是由于浓H2SO4具有吸水性 | |
| B. | 浓H2SO4和木炭能反应,是利用浓H2SO4的强氧化性 | |
| C. | 浓硫酸可以用于干燥Cl2,是利用浓H2SO4的吸水性 | |
| D. | 反应CuSO4+H2S=CuS↓+H2SO4能进行,说明CuS既难溶于水,也难溶于稀硫酸 |
20.在25℃,101k P的条件下,5.2g C2H2完全燃烧生成CO2和H2O(l)时放出259.92kJ热量.表示上述反应的热化学方程式正确的是( )
| A. | 1/5C2H2(g)+1/2O2(g)=2/5CO2(g)+1/5H2O(l)△H=+259.92 kJ/mol | |
| B. | 0.2C2H2(g)+0.5O2(g)=0.4CO2(g)+0.2H2O(l)△H=-259.92 kJ/mol | |
| C. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=+2599.2 kJ/mol | |
| D. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)△H=-2599.2 kJ/mol |
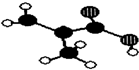 浙江东方化工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).
浙江东方化工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).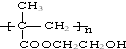 .
.