题目内容
15.下列实验操作、现象和结论均正确的是( )| 选项 | 实验操作 | 现象 | 结论 |
| A | CH2=CH2通入溴的四氯化碳溶液中 | 溶液褪色 | CH2=CH2发生取代反应 |
| B | KIO3溶液中加入HI溶液并加入淀粉 | 溶液变蓝色 | 氧化性:KIO3>I2 |
| C | 将盛满氯气的试管倒扣在水槽中,放在日光下静置一段时间 | 气体逐渐减少,最后变为无色 | Cl2置换出水中的氧生成了O2 |
| D | 将苯、溴水混合后加入大试管加热 | 试管底部产生油状物 | 苯发生取代反应生成溴苯 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溴和碳碳双键能发生加成反应;
B.氧化剂的氧化性大于氧化产物的氧化性;
C.氯气和水反应生成HCl和HClO,HClO不稳定,易分解生成氧气;
D.苯和液溴在溴化铁作催化剂条件下能反应生成溴苯,苯能萃取溴水中的溴.
解答 解:A.溴和碳碳双键能发生加成反应生成1,2-二溴乙烷,该反应是加成反应不是取代反应,故A错误;
B.氧化剂的氧化性大于氧化产物的氧化性,淀粉试液变蓝色,说明碘酸钾和HI发生氧化还原反应生成碘,碘酸钾中I元素化合价由+5价变为0价、HI中I元素化合价由-1价变为0价,所以碘酸钾是氧化剂、碘是氧化产物,则氧化性KIO3>I2,故B正确;
C.氯气和水反应生成HCl和HClO,HClO不稳定,易分解生成氧气,所以氧气是次氯酸分解得到的不是氯气和水发生置换反应得到的,故C错误;
D.苯和液溴在溴化铁作催化剂条件下能反应生成溴苯,苯能萃取溴水中的溴而使溴水褪色,苯密度小于溴,所以油状液体应该在试管上部,故D错误;
故选B.
点评 本题考查化学实验方案评价,侧重考查学生分析判断能力,涉及萃取、氧化还原反应、取代反应等知识点,明确物质性质是解本题关键,易错选项是C.

练习册系列答案
相关题目
5.下列应用中,主要利用物质氧化性的是( )
| A. | 用烟道气中和碱性废水 | B. | 重铬酸钾用于酒驾检査 | ||
| C. | 用苯酚制造酚醛树脂 | D. | 金属加工前用硫酸酸洗 |
6. 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
(1)已知2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
H2O(g)=H2O(1)△H=-44.0kJ/mol
甲醇不完全燃烧生成气态水的热化学方程式为2CH3OH(l)+O2(g)=2CO(g)+4H2O(l)△H=-533.6kJ•mol-1
若不完全燃烧20g甲醇生成液态水,此时放出的热量为333.5kJ
(2)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
计算上述反应的焓变△H=(2d+6b-3a-c-3e)kJ/mol(用相应字母表示),若只加压,则平衡常数K不变(选填“增大”,“减小”或“不变”);
(3)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g)
若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如表:
下列关系正确的是AD
A.c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1+a2=1
E.该反应若生成1molCH2OH,则放出(Q1+Q3)kJ热量
(4)若在一体积可变的密闭容器中充入1molCO、2molH2和1molCH2OH,达到平衡时测得混合气体的密度是同温同压下起始密度的1.6倍,则达平衡前v(正)>v(逆)(填“>”、“<”或“=”);
(5)甲醇一空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间后纯Cu质量增加3.2g(粗铜中杂质不参与电极反应).
①请写出燃料电池中的负极反应式:CH3OH-6e-+8OH-=CO32-+6H2O
②燃料电池正极消耗空气的体积是2.8L(标准状态,空气中O2体积分数以20%计算).
 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.(1)已知2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
H2O(g)=H2O(1)△H=-44.0kJ/mol
甲醇不完全燃烧生成气态水的热化学方程式为2CH3OH(l)+O2(g)=2CO(g)+4H2O(l)△H=-533.6kJ•mol-1
若不完全燃烧20g甲醇生成液态水,此时放出的热量为333.5kJ
(2)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
| 化学键 | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | a | b | c | d | e |
(3)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g)
若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如表:
| 容器 | 反应物投入的量 | 反应物的转化率 | CH2OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1molCO和2molH2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1molCH3OH | a2 | c2 | 放出Q2kJ热量 |
| 丙 | 2molCO和4molH2 | a3 | c3 | 放出Q3kJ热量 |
A.c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1+a2=1
E.该反应若生成1molCH2OH,则放出(Q1+Q3)kJ热量
(4)若在一体积可变的密闭容器中充入1molCO、2molH2和1molCH2OH,达到平衡时测得混合气体的密度是同温同压下起始密度的1.6倍,则达平衡前v(正)>v(逆)(填“>”、“<”或“=”);
(5)甲醇一空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间后纯Cu质量增加3.2g(粗铜中杂质不参与电极反应).
①请写出燃料电池中的负极反应式:CH3OH-6e-+8OH-=CO32-+6H2O
②燃料电池正极消耗空气的体积是2.8L(标准状态,空气中O2体积分数以20%计算).
3.下列实验目的能实现的是( )
| A. |  实验室制取乙炔 | B. |  实验室制取Fe(OH)2 | ||
| C. |  实验室制取少量氨气 | D. |  实验室制取乙酸丁酯 |
20.某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,设计如图原电池,盐桥中装有饱和溶液.下列说法正确的是( )


| A. | b电极上发生还原反应 | |
| B. | 外电路电子的流向是从a到b | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O |
5.下列说法正确的是( )
| A. | 因为水分子间存在氢键,所有水分子较稳定 | |
| B. | 碘固体升华过程中吸收的热量用于克服碘原子间的作用力 | |
| C. | 溴化氢溶于水能电离出H+、Br-,所以溴化氢是离子化合物 | |
| D. | 纯碱和烧碱的熔化均破坏了离子键 |

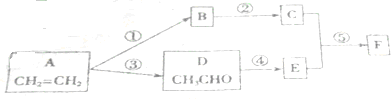
 .
. (其中一种).
(其中一种). )的合成路线.
)的合成路线.
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +nH2O.
+nH2O. .
.

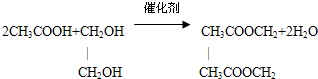 .
.