题目内容
【题目】遵义市某些地区出现了不同程度的雾霾天气,我校课题小组的同学对其进行了调查研究,
Ⅰ.课题小组研究发现,其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。
(1)25℃时将PM2.5样本用蒸馏水处理制成待测溶液。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
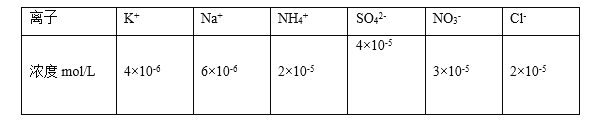
根据表中数据判断试样的pH=________。
Ⅱ.课题组就其酸性物质做进一步研究
一氧化氮、二氧化氮的研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应:
2NO(g)+O2(g) ![]() 2NO2(g),下列状态能说明该反应达到化学平衡的是_______(填字母编号)。
2NO2(g),下列状态能说明该反应达到化学平衡的是_______(填字母编号)。
A.混合气体的密度保持不变 B.NO的转化率保持不变
C.NO和O2的物质的量之比保持不变 D.O2的消耗速率和NO2的消耗速率相等
(2)活性炭可处理大气污染物NO,反应原理为:C(s)+2NO(g)![]() N2(g)+CO2(g),T℃时,在2L密闭容器中加入0.100mol NO和2.030mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol,则该温度下的平衡常数为_________;达平衡时,若再向容器中充入0.04molNO,0.03molN2和0.03molCO2,则平衡________移动。(填“向左”“向右”或“不”)
N2(g)+CO2(g),T℃时,在2L密闭容器中加入0.100mol NO和2.030mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol,则该温度下的平衡常数为_________;达平衡时,若再向容器中充入0.04molNO,0.03molN2和0.03molCO2,则平衡________移动。(填“向左”“向右”或“不”)
III.一氧化碳、二氧化碳的研究
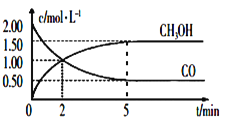
(1)CO或CO2在一定条件下可以用来合成甲醇。工业上常用CO和H2制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到5min,用H2表示的平均反应速率v(H2)=_____。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到5min,用H2表示的平均反应速率v(H2)=_____。
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △ H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △ H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △ H= - 178.3kJ/mol
①计算反应Ⅳ:C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=______kJ/mol;
CaCO3(s)+2H2(g)的△H=______kJ/mol;
对硫的氧化物的研究
②SO2可被Na2FeO4氧化而去除污染,工业上用Fe和石墨作电极电解浓NaOH溶液制备Na2FeO4。写出电解过程中阳极发生的电极反应________。
【答案】4 BC ![]() (或0.5625) 不 0.6mol/(Lmin) -90.3; Fe-6e+8OH-=FeO42-+4H2O
(或0.5625) 不 0.6mol/(Lmin) -90.3; Fe-6e+8OH-=FeO42-+4H2O
【解析】
Ⅰ.(1)根据溶液中电荷守恒计算;
II.(1)根据平衡时任何一组分的物质的量不变,物质的浓度不变,物质是平衡含量不变分析判断;
(2)根据平衡常数的表达式书写、计算;并根据浓度商与化学平衡常数大小判断平衡移动方向;
III.(1)先根据图示计算出CO的反应速率,然后根据H2、CO的反应关系计算出H2表示的化学反应速率;
(2)①根据盖斯定律,将已知的热化学方程式叠加,可以得到相应反应的热化学方程式;
②阳极Fe失去电子,发生氧化反应产生FeO42-。
Ⅰ.(1)溶液中电荷守恒:c(K+)+c(NH4+)+c(Na+)+c(H+)=2c(SO42-)+c(NO3-)+c(Cl-),将表中数据带入可得4×10-6+2×10-5+6×10-6+c(H+)=2×4×10-5+3×10-5+2×10-5,解得c(H+)=1×10-4mol/L,所以溶液的pH=4;
II.(1)A.由于反应混合物都是气体,物质的质量不变,容器的容积不变,所以混合气体的密度始终保持不变,因此不能据此判断反应是否处于平衡状态,A错误;
B.若反应未达到平衡,NO的转化率就会发生变化因此若NO的转化率保持不变,反应处于平衡状态,B正确;
C.NO和O2反应的物质的量的比是2:1,加入的物质的物质的量的比是1:1,因此若二者的物质的量之比保持不变,反应达到平衡状态,C正确;
D.根据方程式可知:每反应消耗1个O2,会同时反应产生2个NO2,所以O2的消耗速率和NO2的消耗速率相等,则反应正向进行,未达到平衡状态,D错误;
故合理选项是BC;
(2)可逆反应:C(s) + 2NO(g)![]() N2(g)+CO2(g),反应容器为2L
N2(g)+CO2(g),反应容器为2L
n(开始)mol 2.030 0.100 0 0
n(变化)mol 0.030 0.060 0.030 0.030
n(平衡)mol 2.000 0.040 0.030 0.030
则该反应的化学平衡常数K=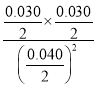 =
=![]() =0.5625;
=0.5625;
当反应达到平衡后再加入0.04molNO、0.03molN2和0.03molCO2,Qc=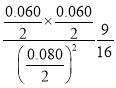 =0.5625=K,则平衡不移动;
=0.5625=K,则平衡不移动;
III.(1)V(CO)=![]() =0.3 mol/(Lmin),根据反应方程式中物质反应转化关系可知V(H2):V(CO)=2:1,所以V(H2)=2V(CO)=0.6 mol/(Lmin);
=0.3 mol/(Lmin),根据反应方程式中物质反应转化关系可知V(H2):V(CO)=2:1,所以V(H2)=2V(CO)=0.6 mol/(Lmin);
(2)①Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △ H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △ H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △ H= - 178.3kJ/mol
根据盖斯定律,将I+II+III,整理可得C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g) △H=+131.0kJ/mol-43kJ/mol-178.3kJ/mol=-90.3 kJ/mol;
CaCO3(s)+2H2(g) △H=+131.0kJ/mol-43kJ/mol-178.3kJ/mol=-90.3 kJ/mol;
②以Fe为阳极,在电解浓NaOH溶液制备Na2FeO4,电极反应式为Fe-6e+8OH-=FeO42-+4H2O。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】向一个容积为2L的密闭容器中充入2mol NH3和3 mol O2,在恒温和催化剂作用下发生反应:4NH3(g)+5O2(g)4NO(g) + 6H2O(l) ,经过5min后达到平衡状态。此时,c(NH3):c(O2)=4:7。则:
(1)反应开始至平衡时,以NO的浓度变化表示该反应的平均速率v(NO)=__________。
(2)起始状态与平衡状态容器内的压强之比为______。
(3)该条件下反应一段时间,下列能说明反应达到平衡状态的是___________ 。
A.c(H2O)保持不变的状态 B.气体的压强保持不变的状态
C.4v正(NH3)=5v逆(O2) D.NH3与O2浓度之比保持不变的状态
(4)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
A | B | C | D | E | F | |
4mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1 = _________ ,V6 = _________ 。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因______________ 。