题目内容
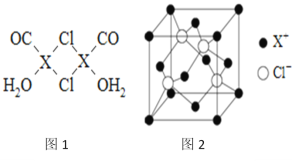
【题目】元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2·2CO·2H2O
(1)X基态原子的电子排布式为__________________.
(2)C、H、O三种原子的电负性由大到小的顺序为__________.
(3)X2Cl2·2CO·2H2O是一种配合物,其结构如图1所示:
①与CO为互为等电子体的分子是_________.
②该配合物中氯原子的杂化方式为__________.
③在X2Cl22CO2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键_____________.
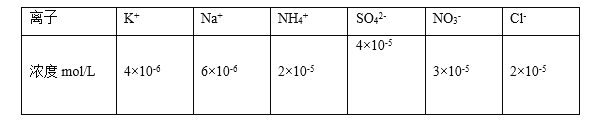
(4)阿伏加德罗常数的测定有多种方法,X射线衍射法就是其中的一种。通过对XCl晶体的X射线衍射图象的分析,可以得出XCl的晶胞如图2所示,则距离每个X+最近的Cl﹣的个数为____________,若X原子的半径为a pm,晶体的密度为ρg/cm3,试通过计算阿伏加德罗常数NA=___________________(列计算式表达)
【答案】1s22s22p63s23p63d104s1或[Ar]3d104s1 O>C>H N2 sp3 ![]() 4
4 
【解析】
元素X的基态原子中的电子共有7个能级,说明有四个电子层,且最外层电子数为1,X原子的内层轨道全部排满电子说明3d轨道排满,即为Cu[Ar]3d104s1。
⑴X为Cu,基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,
故答案为1s22s22p63s23p63d104s1或[Ar]3d104s1;
⑵同周期,从左到右,电负性逐渐增大,即O>C,非金属性越强,电负性越强,所以C>H,即O>C>H,
故答案为O>C>H;
⑶X2Cl2·2CO·2H2O是一种配合物,
①找等电子体,找与这些原子相邻的原子,因此CO互为等电子体的分子是N2,
故答案为N2;
②氯有2个δ键,还有两对孤对电子,因此氯原子的杂化方式为sp3,
故答案为sp3;
③在X2Cl22CO2H2O中,每个X原子能与其他原子形成3个配位键,CO、H2O、Cl-各提供孤对电子,亚铜离子提供空轨道,因此配位键图示为![]() ,
,
故答案为![]() ;
;
⑷ XCl的晶胞如图2所示,以面心分析,左边两个Cl-,右边两个Cl-,即距离每个X+最近的Cl-的个数为4,若X原子的半径为a pm,即每个边长为![]() pm,晶体的密度为ρg/cm3,每个晶胞中有4个Cu+,4个Cl-,
pm,晶体的密度为ρg/cm3,每个晶胞中有4个Cu+,4个Cl-,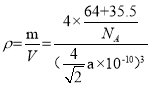 ,
,
阿伏加德罗常数 ,
,
故答案为

【题目】在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表。忽略溶液体积变化,下列叙述不正确的是
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.6 | 16.8 | 22.4 | 26.5 | 29.9 |
A.该反应可用MnO2、FeCl3溶液作为催化剂
B.0~4 min的平均反应速率v(H2O2)=3.75×10-2mol/(L·min)
C.0~10 min,过氧化氢的分解速率逐渐加快
D.反应到6 min时,H2O2分解了50%