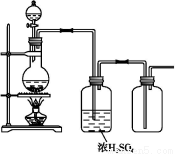
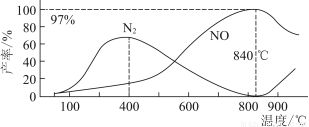
��Ŀ����
������,��ijһԪ��HA(�ס��ҡ�������������ͬ��һԪ��)��NaOH��Һ��������,������Һ�����ʵ���Ũ�Ⱥͻ����Һ��pH�����ʾ:
ʵ���� | HA�����ʵ� ��Ũ��(mol��L-1) | NaOH�����ʵ� ��Ũ��(mol��L-1) | ��Ϻ��� Һ��pH |
�� | 0.1 | 0.1 | pH=a |
�� | 0.12 | 0.1 | pH=7 |
�� | 0.2 | 0.1 | pH>7 |
�� | 0.1 | 0.1 | pH=10 |
(1)�Ӽ����������,����ж�HA��ǿ�ỹ������?
(2)��������Һ������Ũ��c(A-)��c(Na+)�Ĵ�С��ϵ�������� ����
A.ǰ�ߴ� B.���ߴ� C.�������D.���ж�
(3)�ӱ���ʵ��������,�û����Һ������Ũ���ɴ�С��˳������ ��
(4)��������ʵ������,д���û����Һ��������ʽ�ľ�ȷ���(��ʽ):
c(Na+)-c(A-)=����������������mol��L-1��
(1)a=7ʱ,HA��ǿ��;a>7ʱ,HA������
(2)C
(3)c(Na+)>c(A-)>c(OH-)>c(H+)
(4)(10-4-10-10)
��������(1)һԪ��HA��NaOH�����ʵ�����Ӧ,����ǿ��ȡ������ȫ�кͺ�����Һ��pH,a=7ʱΪǿ��,a>7ʱΪ����;(2)�ݵ���غ�,��c(Na+)+c(H+)=c(A-)+c(OH-),��c(H+)=c(OH-),����c(Na+)=c(A-);(3)��Ϊ��Ũ�ȵ�HA��NaA�Ļ����Һ,��pH>7֪A-ˮ��̶ȴ���HA�ĵ���,����Ũ�ȴ�С��ϵΪc(Na+)>c(A-)>c(OH-)>c(H+);(4)�ݵ���غ�c(Na+)+c(H+)=c(A-)+c(OH-),�Ƶ�c(Na+)-c(A-)=c(OH-)-c(H+)=10-4 mol/L-10-10 mol/L��

�±����������ε��ܶȻ�����(25 ��):
��ѧʽ | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
�ܶȻ� | 1.8��10-10 | 1.4��10-5 | 6.3��10-50 | 7.7��10-13 | 8.51��10-16 |
����˵������ȷ����(����)
A.���������ڳ�����Ag2SO4������Һ��c(Ag+)���
B.���Ȼ����ܽ���ˮ��,�����м���Na2S,��������ɺ�ɫ����
C.�����Ȼ������廯���͵⻯�����������ڳ����µı�����Һ��c(Ag+)�����ȡ��塢���˳������
D.�����ܽ�ƽ��Ľ�������������,��������ı�ʱ,ƽ��Ҳ�ᷢ���ƶ�