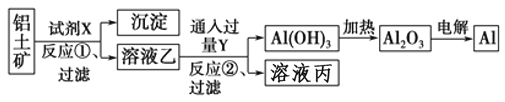
��Ŀ����
����Ŀ��ijС��������ͼ��ʾװ���Ʊ�����NCl3����֪��NCl3����Cl2��NH4Cl��Һ�������¶��·�Ӧ���ɡ������£�NCl3Ϊ��ɫ��״Һ�壬�۵�Ϊ-40�棬�е�Ϊ71�棻���ױ�ը����Ȼ��ը��Ϊ95�档
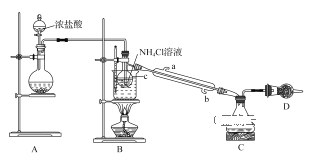
�ش��������⣺
��1��װ��A��Բ����ƿ����ʢ�ŵĹ�����___���ѧʽ����
��2��װ��B������C��������___��ʵ������и������ڷ�����Ӧ�Ļ�ѧ����ʽΪ___��
��3��װ��B���ձ���Ӧ����ˮԡ���ȵ��¶ȷ�ΧΪ____��
��4��װ��D����ʢ�ŵ��Լ�����Ϊ����ѡ���е�___������ĸ����
a����ʯ�� b��NaOH���� C����ʯ�� d����ˮCaCl2
��5���������Ͽ�֪�����pH<5��NH4Cl��ҺҲ���Ƶ�NCl3��������в���NCl3�ĵ缫Ϊ___��������������������������õ缫�ĵ缫��ӦʽΪ___��
���𰸡�KMnO4��KClO3��Ca(ClO)2�� ������ƿ NH4Cl+3Cl2=NCl3+4HCl 71��95�� d ���� 3Cl-+NH4+-6e-=NCl3+4H+
��������
��1��װ��A��������ȡ������װ�ã��÷�Ӧ����Ҫ���ȣ��ʲ���ʹ�ö������̣�������ȡ�����ķ���ΪŨ�����������ػ�������ػ���������εȲ���Ҫ���ȶ�������ȡ������
����KMnO4��KClO3��Ca(ClO)2��
��2��װ��B������C��������������ƿ��ʵ������и������ڷ�����ӦΪ�������Ȼ����ˮԡ���ȵ������·���������ԭ��Ӧ��ȡ���Ȼ�������ѧ����ʽΪNH4Cl+3Cl2=NCl3+4HCl��
��Ϊ��������ƿ��NH4Cl+3Cl2=NCl3+4HCl��
��3������Ŀ��Ϣ�������£�NCl3Ϊ��ɫ��״Һ�壬�۵�Ϊ-40�����е�Ϊ71�������ױ�ը����Ȼ��ը��Ϊ95����Ҫ�ռ�NCl3�¶Ȳ��õ���71������ֹ��ը��Ȼ���¶Ȳ��ó���95����
����71��95����
��4��װ��DΪβ������װ�ã�װ������δ���뷴Ӧ���������ж������ڴ�����Ⱦ���Ҫ���մ�������ˮ�Ȼ����������Ը�������������ն���δ��Ӧ���������������ڸ�ʵ���β��������
��ѡd��
��5���������Ͽ�֪�����pH<5��NH4Cl��ҺҲ���Ƶ�NCl3�����ݻ��ϼ۱仯��N��3�۱�Ϊ+3�ۣ�ʧȥ���ӣ��ڵ�����ӦΪ������Ӧ��������в���NCl3�ĵ缫Ϊ�����������ĵ缫��ӦʽΪ��3Cl-+NH4+-6e-=NCl3+4H+��
�ʴ�Ϊ�������� 3Cl-+NH4+-6e-=NCl3+4H+��

 ��������ϵ�д�
��������ϵ�д� ��ӡ�Ļ���ʱ����ϵ�д�
��ӡ�Ļ���ʱ����ϵ�д� ��ѧ�����ϵ�д�
��ѧ�����ϵ�д�����Ŀ��Ϊ���ƴ����ȼ���������ҵ�ĸ�����CCl4���Լ�����Գ�������ƻ�����ѧ���о��ڴ��������£�ͨ�����з�Ӧ��CCl4��H2 ![]() CHCl3��HClʹCCl4ת��Ϊ��Ҫ�Ļ���ԭ���ȷ�(CHCl3)���˷�Ӧ�����и���Ӧ��������CH2Cl2��CH3Cl��CH4 �ȡ���֪CCl4�ķе�Ϊ77 �棬CHCl3�ķе�Ϊ61.2 �档
CHCl3��HClʹCCl4ת��Ϊ��Ҫ�Ļ���ԭ���ȷ�(CHCl3)���˷�Ӧ�����и���Ӧ��������CH2Cl2��CH3Cl��CH4 �ȡ���֪CCl4�ķе�Ϊ77 �棬CHCl3�ķе�Ϊ61.2 �档
(1)���ܱ������У��÷�Ӧ�ﵽƽ��״̬�����������(���費���Ǹ���Ӧ)��
ʵ�� ��� | �¶�/�� | ��ʼCCl4��Ũ�� (mol��L��1) | ��ʼH2��Ũ�� (mol��L��1) | CCl4��ƽ��ת���� |
1 | 110 | 0.8 | 1.2 | A |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | B |
�ٴ˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ_____________��
��ʵ��1�У�CCl4��ת����A________50%(������������С��������������)��
��ʵ��2�У�10 h��ﵽƽ�⣬H2��ƽ����Ӧ����Ϊ________________��
��ʵ��3�У�B��ֵ________(�����)��
A ����50% B ����50% C С��50% D �ӱ����������ж�
(2)120 ��ʱ������ͬ�������ܱ������У��ֱ����H2 �ij�ʼŨ��Ϊ2 mol��L��1��4 mol��L��1��ʵ�飬��÷�Ӧ����CCl4�İٷ���(x%)����������CHCl3�İٷֺ���(y%)��ʱ��(t)�ı仯��ϵ��ͼ(ͼ��ʵ��������CCl4�İٷ��ʱ仯���ߣ������Dz�����CHCl3�İٷֺ����仯����)��

����ͼ�е��������У���ʾH2����ʼŨ��Ϊ2 mol��L��1��ʵ������CCl4�İٷ��ʱ仯���ߵ���________(�����)��
�ڸ�����ͼ���ߣ���������ʼŨ��Ϊ________ mol��L