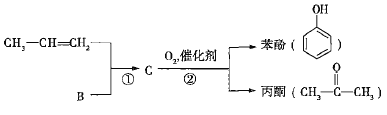
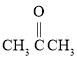题目内容
【题目】碳及其化合物有许多用途。回答下列问题:
⑴碳元素有12C、13C和14C等核素。下列对12C基态原子结构的表示方法中,对电子运动状态描述最详尽的是_______(填标号)。
A. B.
B.![]()
C.1s22s22p2 D.
基态13C原子核外有________种不同空间运动状态的电子。
⑵K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键的类型为________,该化学键能够形成的原因是________。
⑶有机物 是________(填“极性”或“非极性”)分子;该有机物中存在sp3杂化的原子,其对应元素的第一电离能由大到小的顺序为________。
是________(填“极性”或“非极性”)分子;该有机物中存在sp3杂化的原子,其对应元素的第一电离能由大到小的顺序为________。
⑷乙二胺(H2NCH2CH2NH2)和三甲胺[N(CH3)3]均属于胺,两者相对分子质量接近,但乙二胺比三甲胺的沸点高得多,原因是________。
⑸碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和金属阳离子半径:
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
金属阳离子半径/pm | 66 | 99 | 112 | 135 |
随着金属阳离子半径的增大,碳酸盐的热分解温度逐步升高,原因是________。
⑹石墨的晶体结构和晶胞结构如图所示。已知石墨的密度为ρgcm-3,C—C键长为γ cm,阿伏加德罗常数的值为NA,则石墨晶体的层间距为________cm。

【答案】D 6 配位键 Fe3+提供空轨道,CN-提供孤电子对形成配位键 极性 N > O > C 乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键 碳酸盐在热分解过程中,晶体中的金属阳离子与CO32-中的氧原子接合,使CO32-分解为CO2。当金属阳离子所带电荷数相同时,阳离子半径越大,其结合CO32-中的氧原子的能力就越弱,对应的碳酸盐就越难分解,所需热分解温度就越高 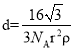
【解析】
⑴碳元素有12C、13C和14C等核素,作为同位素,质子数一样,核外电子排布一样,C原子核外电子排布为1s22s22p2,对电子运动状态描述最详尽的是轨道表达式,基态13C原子核外有6种不同空间运动状态的电子。
⑵ Fe3+与CN-之间的化学键类型为配位键,Fe3+有空轨道,能接受孤对电子,CN-提供孤对电子,所以能形成配位键。
⑶有机物![]() 是极性分子,第一电离能增大趋势,但有特殊。
是极性分子,第一电离能增大趋势,但有特殊。
⑷乙二胺分子间可以形成氢键。
⑸碳酸盐在热分解过程中,当金属阳离子所带电荷数相同时,阳离子半径越大,其结合CO32-中的氧原子的能力就越弱,对应的碳酸盐就越难分解,所需热分解温度就越高。
⑹根据石墨的晶胞结构,先求底面积,求出C原子数目,根据密度等于质量除以体积进行计算。
⑴碳元素有12C、13C和14C等核素,作为同位素,质子数一样,核外电子排布一样,C原子核外电子排布为1s22s22p2,轨道式为如图所示:![]() ,则在基态14C原子中,对电子运动状态描述最详尽的是D,基态13C原子核外有6种不同空间运动状态的电子;故答案为:D;6。
,则在基态14C原子中,对电子运动状态描述最详尽的是D,基态13C原子核外有6种不同空间运动状态的电子;故答案为:D;6。
⑵K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为配位键,Fe3+有空轨道,能接受孤对电子,CN-提供孤对电子,所以能形成配位键;故答案为:配位键;Fe3+提供空轨道,CN-提供孤电子对形成配位键。
⑶有机物![]() 是极性分子,化合物中O、N、C三种原子的杂化轨道形成均为sp3,其对应元素的第一电离能由大到小的顺序为:N > O > C;故答案为:极性;N > O > C。
是极性分子,化合物中O、N、C三种原子的杂化轨道形成均为sp3,其对应元素的第一电离能由大到小的顺序为:N > O > C;故答案为:极性;N > O > C。
⑷乙二胺比三甲胺的沸点高得多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;故答案为:乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键。
⑸碳酸盐在热分解过程中,晶体中的金属阳离子与CO32-中的氧原子接合,使CO32-分解为CO2。当金属阳离子所带电荷数相同时,阳离子半径越大,其结合CO32-中的氧原子的能力就越弱,对应的碳酸盐就越难分解,所需热分解温度就越高;故答案为:碳酸盐在热分解过程中,晶体中的金属阳离子与CO32-中的氧原子接合,使CO32-分解为CO2。当金属阳离子所带电荷数相同时,阳离子半径越大,其结合CO32-中的氧原子的能力就越弱,对应的碳酸盐就越难分解,所需热分解温度就越高。
⑹根据石墨的晶胞结构,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为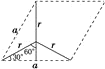 ,则
,则![]() ,可得
,可得![]() ,则底面面积为
,则底面面积为![]() ,晶胞中C原子数目为
,晶胞中C原子数目为![]() ,晶胞质量为
,晶胞质量为![]() ,则
,则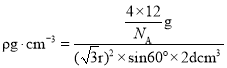 ,整理可得
,整理可得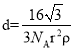 ;故答案为:
;故答案为: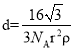 。
。