题目内容
【题目】下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.![]()
![]()
![]() 的
的![]() 溶液中:
溶液中:![]()
B.在![]() 溶液中一定有:
溶液中一定有:![]()
C.![]() 相等的
相等的![]() 溶液、
溶液、![]() 溶液和
溶液和![]() 溶液:
溶液:![]()
D.10mL![]()
![]()
![]() 溶液与10mL1
溶液与10mL1![]() 盐酸混合:
盐酸混合:![]()
【答案】D
【解析】
A.![]() 溶液溶液呈酸性,说明
溶液溶液呈酸性,说明![]() 的电离程度大于水解程度,但是其电离和水解程度都较小,则
的电离程度大于水解程度,但是其电离和水解程度都较小,则![]() ,故A错误;
,故A错误;
B.根据电荷守恒,在![]() 溶液中一定有:
溶液中一定有:![]() ,故B错误;
,故B错误;
C.铵根离子和碳酸根离子相互促进水解,氯化铵化学式中含有一个铵根离子,硫酸铵和碳酸铵化学式中含有两个铵根离子,所以铵根离子浓度相等的![]() 溶液、
溶液、![]() 溶液和
溶液和![]() 溶液:
溶液:![]() ,故C错误;
,故C错误;
D.二者混合溶液,溶液中的溶质是物质的量浓度相等的NaCl、![]() 、HCl,混合溶液呈酸性,氯化氢完全电离、醋酸部分电离、氯化钠完全电离,所以根据物料守恒得
、HCl,混合溶液呈酸性,氯化氢完全电离、醋酸部分电离、氯化钠完全电离,所以根据物料守恒得![]() ,故D正确;
,故D正确;
选D。

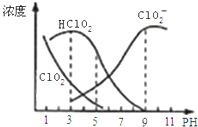
【题目】下表是![]() 时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )
时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )
化学式 | AgCl |
|
| HClO |
|
|
|
|
|
|
|
A.相同浓度![]() 和
和![]() 的混合液中,各离子浓度的大小关系是
的混合液中,各离子浓度的大小关系是![]()
B.碳酸钠溶液中滴加少量氯水的离子方程式为![]()
C.向![]() HClO溶液中滴加NaOH溶液至
HClO溶液中滴加NaOH溶液至![]() :
:![]() 1:3,此时溶液
1:3,此时溶液![]()
D.向浓度均为![]() 的KCl和
的KCl和![]() 混合液中滴加
混合液中滴加![]() 的
的![]() 溶液,
溶液,![]() 先形成沉淀
先形成沉淀
【题目】碳及其化合物有许多用途。回答下列问题:
⑴碳元素有12C、13C和14C等核素。下列对12C基态原子结构的表示方法中,对电子运动状态描述最详尽的是_______(填标号)。
A. B.
B.![]()
C.1s22s22p2 D.
基态13C原子核外有________种不同空间运动状态的电子。
⑵K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键的类型为________,该化学键能够形成的原因是________。
⑶有机物 是________(填“极性”或“非极性”)分子;该有机物中存在sp3杂化的原子,其对应元素的第一电离能由大到小的顺序为________。
是________(填“极性”或“非极性”)分子;该有机物中存在sp3杂化的原子,其对应元素的第一电离能由大到小的顺序为________。
⑷乙二胺(H2NCH2CH2NH2)和三甲胺[N(CH3)3]均属于胺,两者相对分子质量接近,但乙二胺比三甲胺的沸点高得多,原因是________。
⑸碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和金属阳离子半径:
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
金属阳离子半径/pm | 66 | 99 | 112 | 135 |
随着金属阳离子半径的增大,碳酸盐的热分解温度逐步升高,原因是________。
⑹石墨的晶体结构和晶胞结构如图所示。已知石墨的密度为ρgcm-3,C—C键长为γ cm,阿伏加德罗常数的值为NA,则石墨晶体的层间距为________cm。