题目内容
3.铁氧体可制备隐形飞机上吸收雷达波的涂料.以废旧锌锰电池为原料制备锌锰铁氧体(MnxZn1-xFe2O4)的主要流程如图1,请回答下列问题:
(1)碱性锌锰电池负极的电极反应式为Zn-2e-+2OH-=Zn(OH)2,酸浸时二氧化锰被双氧水还原的化学方程式为MnO2+H2O2+H2SO4=MnSO4+O2↑+2H2O;
(2)经测定酸浸后的滤液中主要金属阳离子有Mn2+、Hg2+、Zn2+.除汞是以氮气为载气吹入滤液带出汞蒸汽经KMnO4溶液吸收而实现的.如图是KMnO4溶液处于不同pH时对应的Hg去除率变化图2,图中物质为Hg与MnO4-在一定pH范围内的主要产物,则pH<6时的离子反应方程式为5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O,根据该图,你认为pH对汞去除率影响的变化规律是:随pH的升高汞的吸收率先降低后增加;
(3)工艺流程中加入一定量的MnSO4和试剂A的目的是调节溶液中Fe、Mn元素的成分,符合加热后获得锰锌铁氧化体组成;
(4)用试剂B调节pH为10.5左右,试剂B最好是①(填序号);
①氨水 ②NaOH ③NaHCO3
(5)当x=0.2时,所得到的锌锰铁氧体对雷达波的吸收能力特别强,试用氧化物的组合形式表示该锌锰铁氧体的组成MnO•4ZnO•5Fe2O3.
分析 (1)碱性锌锰电池负极发生氧化反应,Zn在负极放电生成Zn(OH)2;酸浸时,双氧水被氧化生成氧气,二氧化锰还原生成硫酸锰,反应还有水生成;
(2)由图可知,pH<6时Hg与酸性高锰酸钾反应生成Hg2+、Mn2+;随pH值的升高汞的去除率先降低后增加;
(3)废电池酸浸得到滤液中液中主要金属阳离子有Mn2+、Hg2+、Zn2+.加入试剂A除Hg,以氮气为载气吹入滤液带出汞蒸汽经KMnO4溶液吸收,由制备锌锰铁氧体(MnxZn1-xFe2O4)可知试剂A为Fe,除汞后的滤液中含有硫酸锌、硫酸亚铁、硫酸锰等,不加入MnSO4和铁粉,进行后续操作,也能得到锰锌铁氧体,而实际中加入需加入一定量的MnSO4和铁粉,应是调节滤液离子的成分;
(4)氢氧化钠可以溶解氢氧化锌,碳酸氢钠溶液pH值小于10.5且可以得到一些碳酸盐沉淀;
(5)Mn为+2价、Zn为+2价,利用化合价代数和为0,计算Fe元素化合价,再结合Mg、Zn、Fe原子数目之比改写为氧化物形式.
解答 解:(1)碱性锌锰电池负极发生氧化反应,Zn在负极放电生成Zn(OH)2,电极反应式为:Zn-2e-+2OH-=Zn(OH)2,酸浸时,双氧水被氧化生成氧气,二氧化锰还原生成硫酸锰,反应还有水生成,反应方程式为:MnO2+H2O2+H2SO4=MnSO4+O2↑+2H2O,
故答案为:Zn-2e-+2OH-=Zn(OH)2;MnO2+H2O2+H2SO4=MnSO4+O2↑+2H2O;
(2)由图可知,pH<6时Hg与酸性高锰酸钾反应生成Hg2+、Mn2+,反应离子方程式为:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O;由图象可知,汞的吸收率随着PH的增大先降低后增加,
故答案为:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O;随pH的升高汞的吸收率先降低后增加;
(3)除汞后的滤液中含有硫酸锌、硫酸亚铁、硫酸锰、硫酸等,不加入MnSO4和铁粉,进行后续操作,也能得到锰锌铁氧体,而实际中加入需加入一定量的MnSO4和铁粉,应是调节滤液离子的成分,符合加热后获得锰锌铁氧化体组成,
故答案为:调节溶液中Fe、Mn元素的成分,符合加热后获得锰锌铁氧化体组成;
(4)氢氧化钠可以溶解氢氧化锌,碳酸氢钠溶液pH值小于10.5且可以得到一些碳酸盐沉淀,使用氨水调节pH最好,故选:①;
(5)Mn为+2价、Zn为+2价,根据化合价代数和为0,可知Fe元素化合价为+3,当x=0.2时,该物质的化学式可表示为Mn0.2Zn0.8Fe2O4,即Mn、Zn、Fe的原子个数之比=1:4:10,所以用氧化物形式可表示为:MnO•4ZnO•5Fe2O3,
故答案为:MnO•4ZnO•5Fe2O3.
点评 本题考查化学工艺流程、物质的分离提纯、对操作的分析评价、氧化还原反应的有关应用、图象分析等,侧重考查学生对知识的迁移运用,并不需要明确每一步骤的目的,结合题目问题进行解答,物质组成的计算、分离提纯以及反应条件的控制等化学工艺流程题是高考的靓点,化学工艺流程是“无机框图题”的变革与创新.

 阅读快车系列答案
阅读快车系列答案| A. | CaCl2 | B. | KCl | C. | H2O | D. | NH4NO3 |
| A. | O2 | B. | H2O | C. | K2SO4 | D. | CH4 |
 苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为: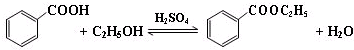
已知(Mr=122)(Mr=150)
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
实验步骤如下:
①在100mL圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按图所示装好仪器,并在分水器中预先加入水,使水面略低于分水器的支管口,控制温度在65~70℃加热回流2h.反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来.在反应过程中,通过分水器下部的旋塞分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中.
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞.继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层.加入氯化钙,对粗产物进行蒸馏(装置如图所示),低温蒸出乙醚后,继续升温,接收210~213℃的馏分.
⑤检验合格,测得产品体积为12.86mL.
回答下列问题:
(1)步骤①中使用分水器不断分离除去水的目的是分离产生的水,使平衡向正反应方向移动,提高转化率.
(2)反应结束的标志分水器中的水层不再增加时,视为反应的终点.
(3)步骤②中应控制馏分的温度在C.
A.65~70℃B.78~80℃C.85~90℃D.215~220℃
(4)若Na2CO3加入不足,在步骤④蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是苯甲酸乙酯中混有未除净的苯甲酸,在受热至100℃时发生升华.
(5)关于步骤④中的分液操作叙述正确的是AD.
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞.将分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔
(6)蒸馏时所用的玻璃仪器除了酒精灯、冷凝管、接收器、锥形瓶外还有蒸馏烧瓶,温度计.
(7)该实验的产率为90%.
| A. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 | |
| B. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| C. | 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 | |
| D. | 分别加入足量锌片,两种溶液生成H2的体积相同 |
| A. | 单质的熔沸点逐渐降低 | B. | 卤素原子半径逐浙减少 | ||
| C. | 最高正化合价逐渐增大 | D. | 单质的氧化性逐渐减弱 |

 (1)基态铬原子的价电子排布式为3d54s1.
(1)基态铬原子的价电子排布式为3d54s1.