题目内容
【题目】I:雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下离子中的若干种:NH4+、Ba2+、Fe2+、Cl-、NO3-、CO32-、SO42-.某同学收集了该地区的雾霾,经必要的预处理后得到试样溶液,设计并完成如下实验:
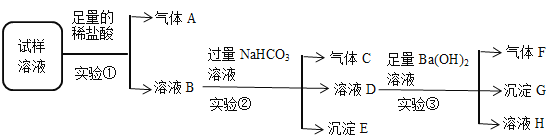
试回答下列问题:
(1)实验①中加入稀盐酸后,有无色气体A生成,气体A遇空气变成红棕色,溶液B依然澄清,且溶液中阴离子种类不变,据此可知原溶液中一定不含__________________。(填离子符号)
(2)实验①中发生反应的离子方程式为_________________________________。
(3)根据实验③现象该同学认为原溶液中一定含有SO42-,有其他同学认为其结论不合理,又进行了后续实验④,最终确认原溶液中含有SO42-,试写出实验④可行的操作方法及现象______________________________。
II :汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(4)氧化还原法消除NOx的转化如下:
![]()
①反应I为NO+O3 = NO2+O2,生成标准状况11.2 L O2时,转移电子的物质的量是______mol。
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为___________。
(5)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。
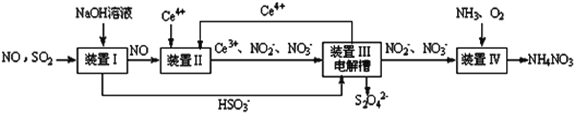
① 装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式________________
② 装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,同时在另一极生成S2O42-的电极反应式为__________。
【答案】CO32- 3Fe2+ + NO3- +4H+ = 3Fe3+ +NO↑ + 2H2O 向沉淀G中加入足量的稀硝酸,若沉淀部分溶解,则证明原溶液中含有SO42- 1 4:3 2NO+3H2O+4Ce4+=NO3-+NO2-+6H++4Ce3+ 2HSO3-+4H++4e-=S2O32-+3H2O
【解析】
I.(1)实验①中加入稀盐酸后,有无色气体A生成,该气体可能为CO2或NO,由于盐酸过量且反应后溶液中阴离子种类不变,则生成的气体为NO,溶液中一定含有Fe2+、Cl-、NO3-,且NO3-过量;根据离子共存可知一定不存在CO32-,故答案为:CO32-;
(2)实验①中亚铁离子与稀硝酸反应生成硝酸铁和一氧化氮和水,反应的离子反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)由于实验②中NaHCO3足量,则实验③的沉淀G中一定含有沉淀BaCO3,不能确定是否含有BaSO4,需要进行后续实验④,可向沉淀G中加入足量的稀硝酸,若沉淀部分溶解,则证明原溶液中含有SO42-,答:向沉淀G中加入足量的稀硝酸,若沉淀部分溶解,则证明原溶液中含有SO42-。
II.(4)①NO+O3═NO2+O2,生成1mol氧气转移电子是2mol,生成11.2L即0.5mol O2(标准状况)时,转移电子的物质的量是0.5mol×2=1mol,故答案为:1;
②当n(NO2):n[CO(NH2)2]=3:2,即NO2和CO(NH2)2的系数之比是3:2,其方程式表示为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2,只有N元素的化合价变化,氮气为氧化产物也是还原产物,由N原子守恒可知氧化产物与还原产物的质量比为8:6=4:3,故答案为:4:3;
(5)①酸性条件下NO被Ce4+氧化的产物主要是NO3-、NO2-,生成等物质的量的NO3-和NO2-时共转移4个电子,应该消耗4个Ce4+,离子方程式为:2NO+3H2O+4Ce4+=NO3-+NO2-+6H++4Ce3+;
②电解池的阴极发生得电子的还原反应,电极反应式为:2HSO3-+4H++4e-=S2O32-+3H2O,阳极电极反应为:Ce3+-e-═Ce4+,故答案为:2HSO3-+4H++4e-=S2O32-+3H2O;

 字词句段篇系列答案
字词句段篇系列答案