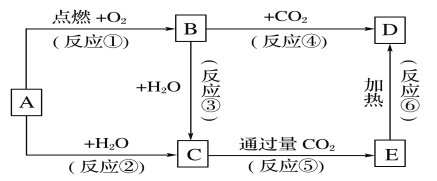
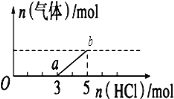
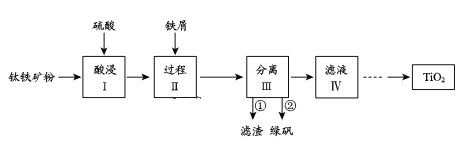
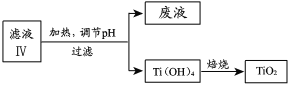
题目内容
【题目】甲醇水蒸气催化重整反应是生产氢能的有效方法之一。
(1)甲醇水蒸气重整制氢存在以下副反应:(已知a、b均大于零)
Ⅰ:甲醇分解 :CH3OH(g) CO(g)+2H2(g) △H= +akJ·mol-1
Ⅱ:水蒸气变换:CO(g)+H2O(g)CO2(g)+ H2(g) △H= ![]() kJ·mol-1
kJ·mol-1
催化重整反应:CH3OH(g) +H2O(g)CO2(g)+ 3H2(g) △H=________kJ·mol-1
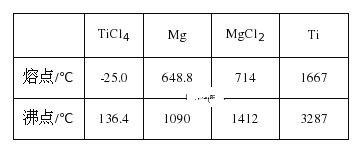
(2)甲醇分解与水蒸气变换反应Kp与温度关系见下表:
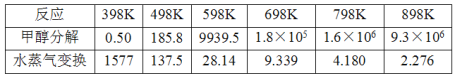
①698K时.CH3OH(g) +H2O(g)CO2(g)+ 3H2(g)的Kp=___________。(保留小数点后二位)
②在较高温度下进行该反应.发现平衡时体系中CO含量偏高的原因是_____________。
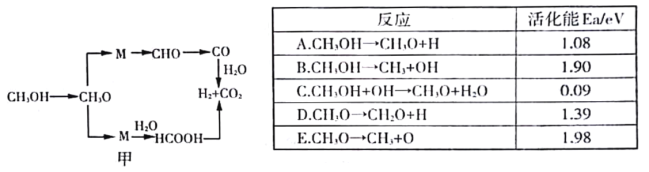
(3)甲醇水蒸气重整反应的可能机理如图甲所示.结合下表分析CH3OH →CH3O的主要反应为______________(填序号),解释原因______________________________________________________________。
(4)某研究小组对重整反应温度(T)与水醇比(![]() )进行优化,得到图乙、丙。
)进行优化,得到图乙、丙。
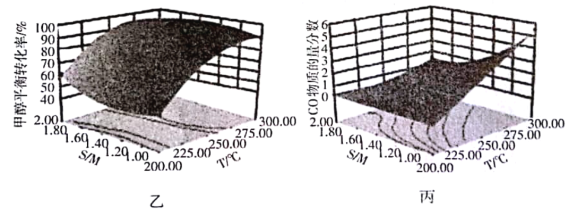
结合图乙分析温度、水醇比与甲醇平衡转化率的关系:________________.
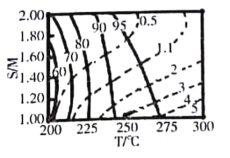
②在图中用阴影画出最优化的反应条件区域(下图为乙和丙组合的平面图,实线为甲醇平衡转化率,虚线为CO物质的量分数):______________
【答案】a-b ![]() 温度升高,反应I正向移动,反应II逆向移动,都会使CO浓度升高 A 反应C的活化能最小,但反应C要用到反应B生成的OH,而反应B活化能非常大,不易发生反应,除了C,反应A活化能小最容易反应,所以主要反应为A; 升高温度,水醇比越大,甲醇转化率越大
温度升高,反应I正向移动,反应II逆向移动,都会使CO浓度升高 A 反应C的活化能最小,但反应C要用到反应B生成的OH,而反应B活化能非常大,不易发生反应,除了C,反应A活化能小最容易反应,所以主要反应为A; 升高温度,水醇比越大,甲醇转化率越大 
【解析】
(1)根据盖斯定律,目标方程为甲醇分解、水蒸气变换两方程叠加,焓变为a-b;
(2) ①Ⅰ、甲醇分解:CH3OH(g) CO(g)+2H2(g)的平衡常数为KP1,Ⅱ、水蒸气变换:CO(g)+H2O(g)CO2(g)+ H2(g)的平衡常数为KP2,反应I+II得到CH3OH(g) +H2O(g)CO2(g)+ 3H2(g)的平衡常数KP=KP1×KP2,698K时KP1=1.8×105,KP2=9.339,所以![]() ;
;
②由题给信息知,反应Ⅰ为吸热反应,升高温度,平衡正向移动,使体系中CO含量增大;反应Ⅱ为放热反应,升高温度,平衡逆向移动,也使体系中CO含量增大,故平衡体系中CO含量高;
故答案为:![]() ;温度升高,反应I正向移动,反应II逆向移动,都会使CO浓度升高;
;温度升高,反应I正向移动,反应II逆向移动,都会使CO浓度升高;
(3) 反应C的活化能最小,但反应C要用到反应B生成的OH,而反应B活化能非常大,不易发生反应,除了C,反应A活化能小最容易反应,所以主要反应为A;
(4) ①图乙是温度、水醇比与甲醇的平衡转化率的关系图,分析可知:当水醇比一定时如1.00,温度升高,甲醇的平衡转化率增大,温度一定(200℃)时,水醇比减小则甲醇的平衡转化率降低,所以温度、水醇比与甲醇的平衡转化率的关系为温度越高、水醇比相对越大,甲醇的平衡转化率越高;
②由图可知:甲醇的平衡转化率最高(为100%)所在曲线与CO的物质的量分数最低(为0.5%)所在曲线围成的区域即为最优化的反应条件区域:温度260℃左右、水醇比1.8以上,此时甲醇的平衡转化率最高,CO的物质的量分数最低,如图阴影部分: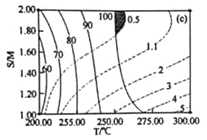 ;
;
故答案为:升高温度,水醇比越大,甲醇转化率越大; 。
。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ||||||
4 | ⑧ | ⑨ | ||||||
请按要求回答下列问题。
(1)这九种元素中,原子半径最大的是(填元素符号)___;元素⑤的原子结构示意图为___。
(2)③、④、⑤三种元素中非金属性最强的元素是(填元素符号)___。
(3)元素⑤、⑦、⑨形成的气态氢化物稳定性最差的是(填写分子式)___。