��Ŀ����
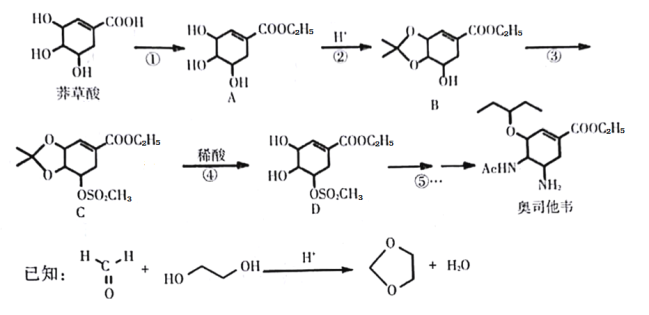
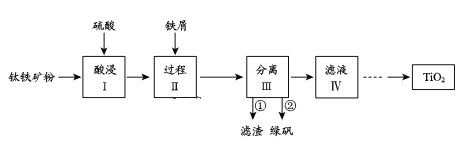
����Ŀ��������������Խ������Ϊ��������֮�����������������������(��Ҫ�ɷ�ΪFeTiO3��������Fe2O3��SiO2������)�������Ʊ�TiO2��ͬʱ�õ�����Ʒ�̷�(FeSO4��7H2O)������������ͼ��ʾ��
��֪����FeTiO3+2H2SO4=FeSO4+TiOSO4+2H2O
��TiO2+��ˮ�⣬ֻ�ܴ�����ǿ������Һ��
��1�����I��Fe2O3��ϡ���ᷴӦ�����ӷ���ʽ��_____��
��2������II�м���������м��Ŀ����____��
��3������III�в���ڵõ��̷��IJ�����_____��
��4������ҺIV��ȡTiO2�Ĺ������£�
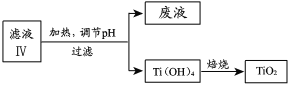
�����û�ѧƽ���ƶ�ԭ��������Һ������е�Ŀ�ģ�______��
����2Mg+TiCl4��Ti+2MgCl2��Ӧ��õ�Mg��MgCl2��Ti�Ļ����ɲ����������ķ�������õ�Ti�����������Ϣ������ȵ��¶��Ը���___�漴�ɡ�
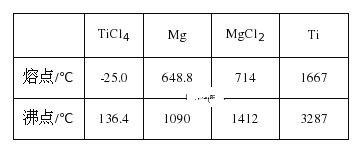
�۵��TiO2�Ʊ��ѵķ�����ͼ��ʾ���÷������ھ߱��������̼������ɱ��͡���Ʒ�����ߡ������Ѻõ�����ŵ������עĿ����֪TiO2����״̬�²��������룬���ʱ������ӦʽΪ____��
���𰸡�Fe2O3+6H+= 2Fe3++3H2O ��Fe3+��ԭΪFe2+ ����Ũ������ȴ�ᾧ������ �÷�ӦΪ���ȷ�Ӧ���¶�����ƽ�������ƶ�������������Ti(OH)4 1412 TiO2+4e-=Ti+2O2-
��������
��������Ҫ�ɷ�ΪFeTiO3��������Fe2O3��SiO2�����ʣ��������ᴦ�����õ�ǿ������Һ�к���TiOSO4��FeSO4��δ��Ӧ������ȣ���������Ŀ���ǽ�Fe3+ת��ΪFe2+����ֹFe3+��TiO2+ͬʱ���ɳ�������Һ����Ҫ����Fe2+��TiO2+���������������Ũ������ȴ�ᾧ�����˵õ��̷�����Һ������Һ���к���TiOSO4���ɵ���pH����TiO��OH��2�����������ȷֽ�����TiO2���Դ˽����⡣
��1����� I��Fe2O3��ϡ���ᷴӦ�����ӷ���ʽΪFe2O3+6H+�T2Fe3++3H2O��
�ʴ�Ϊ��Fe2O3+6H+�T2Fe3++3H2O��
��2�������Ϸ�����֪���� II�м���������м��Ŀ���ǽ�Fe3+��ԭΪFe2+��
�ʴ�Ϊ����Fe3+��ԭΪFe2+��
��3������Һ�õ��̷����壬Ӧ���м���Ũ������ȴ�ᾧ�����ˣ��ʴ�Ϊ������Ũ������ȴ�ᾧ�����ˣ�
��4������Һ���к���TiOSO4��ˮ������ԣ�����TiO2++3H2OTi��OH��4+2H+��ˮ�ⷴӦΪ���ȹ����¶�����ƽ�������ƶ�������������Ti��OH��4��
�ʴ�Ϊ���÷�ӦΪ���ȷ�Ӧ���¶�����ƽ�������ƶ�������������Ti��OH��4��
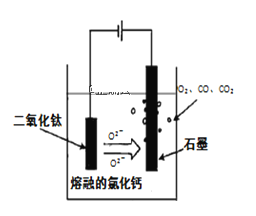
����O2-�����ƶ������֪ͨ��������һ��Ϊ����������������Ӧ����ˮ���缫����ʽΪH2-2e-+O2-�TH2O��
�ʴ�Ϊ��H2-2e-+O2-�TH2O��
���ɱ����е����ݿɵã�Ti���۵����Mg��MgCl2�����¶ȸ���1412�棬Mg��MgCl2���γ���������ʽ����������ѷ��룻
����1412��
�۵��ʱ����������ԭ��Ӧ����ΪTiO2����״̬�²��������룬������TiO2�õ�������Ti���ʺ�O2���缫��ӦʽΪTiO2+4e=Ti+2O2��
�ʴ�Ϊ��TiO2+4e=Ti+2O2����

 ������Ӧ�������������ϵ�д�
������Ӧ�������������ϵ�д� �㽭֮�ǿ�ʱ�Ż���ҵϵ�д�
�㽭֮�ǿ�ʱ�Ż���ҵϵ�д� ����˼ά�żӿ���ϵ�д�
����˼ά�żӿ���ϵ�д�����Ŀ���ⶨ����ͭ���壨CuSO4xH2O����xֵ��ʵ��������£�

���������գ�
��1������Ҫ���к��ز�����ԭ����___��
��2��������ijͬѧ��һ��ʵ���¼��������±���
��������1 | ��������2 | ��������3 | �ᾧˮ��Xֵ | ʵ����� |
11.685g | 13.691g | 12.960g | ____ | ____ |
��3������ʵ����Xֵƫ__���ߡ��ͣ����������ʵ���в�������ԭ�������___��
A������ͭ�����к��в��ӷ������� B��ʵ��ǰ���������ʪ��ˮ
C������ʱ�о���ɽ���ȥ D������ʧˮ��¶���ڿ�������ȴ