题目内容
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ||||||
4 | ⑧ | ⑨ | ||||||
请按要求回答下列问题。
(1)这九种元素中,原子半径最大的是(填元素符号)___;元素⑤的原子结构示意图为___。
(2)③、④、⑤三种元素中非金属性最强的元素是(填元素符号)___。
(3)元素⑤、⑦、⑨形成的气态氢化物稳定性最差的是(填写分子式)___。
【答案】K ![]() F HBr
F HBr
【解析】
由元素在周期表的位置可知,①⑨分别为H、Li、C. N、F. Si、Cl、K、Br,
(1)电子层越多,原子半径越大,同周期从左向右原子半径减小,则这九种元素中,原子半径最大的是K;元素⑤的原子结构中有2个电子层、最外层电子数为7,则F的原子结构示意图为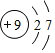 ,
,
故答案为:K;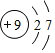 ;
;
(2)同周期从左向右非金属性增强,则③、④、⑤三种元素中非金属性最强的元素是F,故答案为:F;
(3)同主族从上到下非金属性减弱,非金属性越强,对应氢化物越稳定,则元素⑤、⑦、⑨形成的气态氢化物稳定性最差的是HBr,
故答案为:HBr。

练习册系列答案
相关题目