题目内容
【题目】碳及其化合物有着重要用途。回答下列问题:
(1)基态碳原子的价层电子排布图为___________。
(2)在CH2=CHCN中,碳原子的杂化方式有___________、___________,所含σ键数目和π键数目之比为___________。
(3)甲烷、水、氨气中C、O、N原子均采用sp3杂化方式,VSEPR模型均为正四面体构型,比较三者键角的大小___________(由大到小,用H一R—H表示),其原因是___________。
(4)C60室温下为紫红色固体,不溶于水,能溶于四氯化碳等非极性溶剂。据此判断C60的晶体类型是___________。
(5)C60晶胞结构如图,C60分子处于顶点和面心。已知:C60晶胞棱长为14.20 (1=10-8cm),则C60的晶体密度为___________g/cm3。
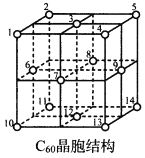
C60体中存在正四面体空隙(例如1、3、6、7四点构成)和正八面体空隙(例如3、6、7、8、9、12六点构成),则平均每一个C60晶胞中有___________个正四面体空隙和4个正八面体空隙。当碱金属元素全部占满所有空隙后,这类C60掺杂物才具有超导性。若用金属铯(Cs)填满所有空隙,距离最近的两个Cs原子间的距离为___________ 。
【答案】 sp、 sp2 2:1 H-C- H>H-N-H>H-O-H C、N、O均为sp3杂化,孤电子对分别为0、1、2,“孤电子对—成键电子对”的斥力大于“成键电子对—成键电子对”的斥力,孤电子对越多斥力越大,键角越小。 分子晶体 1.67 8 7.10
sp、 sp2 2:1 H-C- H>H-N-H>H-O-H C、N、O均为sp3杂化,孤电子对分别为0、1、2,“孤电子对—成键电子对”的斥力大于“成键电子对—成键电子对”的斥力,孤电子对越多斥力越大,键角越小。 分子晶体 1.67 8 7.10
【解析】
(1)基态C原子的核外电子排布式为1s22s22p2,价电子排布式为2s22p2,则价电子排布图为 。
。
(2)CH2=CHCN中,2个C采用sp2杂化、1个C采用sp杂化。![]() 键、π键数目分别为6、3,所含σ键数目和π键数目之比为2:1;答案:sp、sp2;2:1。
键、π键数目分别为6、3,所含σ键数目和π键数目之比为2:1;答案:sp、sp2;2:1。
(3)甲烷、水、氨气中C、O、N原子均采用sp3杂化方式,VSEPR模型均为正四面体构型、理论键角均为10928';但随着孤电子对数目的增多,对成键电子对的斥力越大,实际键角将越小。所以甲烷、水、氨气中C、O、N原子均采用sp3杂化方式,VSEPR模型均为正四面体构型,三者键角的大小为H-C- H>H-N-H>H-O-H;答案:H-C- H>H-N-H>H-O-H;C、N、O均为sp3杂化,孤电子对分别为0、1、2,“孤电子对—成键电子对”的斥力大于“成键电子对—成键电子对”的斥力,孤电子对越多斥力越大,键角越小。
(4)C60是非金属单质晶体,不可能是离子晶体和金属晶体。分子晶体的特点是:熔沸点低,不导电,能溶解在某些溶剂中。而原于晶体一般不溶于其他溶剂。所以C60是分子晶体;答案:分子晶体。
(5)晶胞含有的C60分子数为:8![]() 1/8+6
1/8+6![]() 1/6=4,故密度为4
1/6=4,故密度为4![]() 12
12![]() 60g÷[NA
60g÷[NA![]() (14. 20
(14. 20![]() 10-8cm)3]=1.67g/cm3。正四面体空隙分别是位于1/8晶胞的小立方体的体心位置,共8个(如图
10-8cm)3]=1.67g/cm3。正四面体空隙分别是位于1/8晶胞的小立方体的体心位置,共8个(如图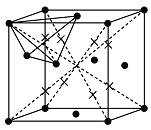 中×),正八面体中心分别位于晶胞体心和晶胞棱中心,1
中×),正八面体中心分别位于晶胞体心和晶胞棱中心,1![]() 1+12
1+12![]() 1/4=4(如图
1/4=4(如图 中)。当Cs原于填入这些空隙后,由这些Cs 原于再次构成立方体,分别位于顶点和体心,故最近的Cs原子为构成的立方体的棱长,等于C60晶胞棱长的1/2 ,即为7.10 。答案:1.67;8;7.10。
中)。当Cs原于填入这些空隙后,由这些Cs 原于再次构成立方体,分别位于顶点和体心,故最近的Cs原子为构成的立方体的棱长,等于C60晶胞棱长的1/2 ,即为7.10 。答案:1.67;8;7.10。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】根据下列五种短周期元素的电离能数据(单位:kJ/mol),回答下面各题。
元素代号 | I1 | I2 | I3 | I4 | I5 |
Q | 800.6 | 2427.1 | 3659.7 | 25025.8 | 32826.7 |
R | 495.8 | 4562 | 6910.3 | 9543 | 13354 |
S | 577.5 | 1816.7 | 2744.8 | 11577 | 14842 |
T | 1402.3 | 2856 | 4578.1 | 7475.0 | 9444.9 |
U | 2080.7 | 3952.3 | 6122 | 9371 | 12177 |
(1)在这五种元素中,最可能处于同一族的两种元素是_________(填元素符号),S元素最可能是_____区元素
(2)基态Q元素原子的价电子排布式是____________。Q和T同周期。化合物QT中T元素的化合价为_______;第一电离能介于Q、T之间的同周期元素有______种。
(3)化合物RT3中化学键类型为_______,RT3的阴离子的几何构型为________。
(4)下列元素中,化学性质和物理性质最像U元素的是_____________
A.硼 B.铍 C.锂 D.氦 E.碳
(5)R的某种氧化物X晶胞结构如图所示,晶胞参数a=0.566 nm,X的化学式为_____;列式并计算晶体X的密度(g·cm-3)_____。