题目内容
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4L H2含有的原子数为NA
B. 等质量的O2和O3中所含的氧分子数相同
C. 常温常压下,14g N2含有电子数为7NA
D. 等质量的CO与CO2中所含碳原子数之比为7﹕11
【答案】C
【解析】
A.标准状况下22.4L氢气的物质的量为1mol,1mol氢气中含有2mol氢原子,含有的原子数为2NA,选项A错误;
B.质量相等的氧气与臭氧中,O原子的数目相同,氧气与臭氧的摩尔质量不同,所以质量相同时,物质的量不同,则分子数不同,选项B错误;
C.14g氮气的物质的量为:![]() =0.5mol,0.5mol氮气中含有1mol氮原子,含有7mol电子,含有电子数为7NA,选项C正确;
=0.5mol,0.5mol氮气中含有1mol氮原子,含有7mol电子,含有电子数为7NA,选项C正确;
D.等质量的CO与CO2中所含碳原子数之比为![]() ﹕
﹕![]() =11:7,选项D错误;
=11:7,选项D错误;
答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol·L-1 H2C2O4溶液 | H2O | 0.2mol·L-1 KMnO4溶液 | 3mol·L-1稀硫酸 | ||
1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6. 4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是____________________;
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:v(KMnO4)= __________;
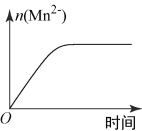
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
|
|
图1 | 图2 |
①该小组同学提出的假设是__________________________________________;
②请你帮助该小组同学完成实验方案,并填完表中空白。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | ||||
0.6mol·L-1 H2C2O4溶液 | H2O | 0.2mol·L-1 KMnO4溶液 | 3mol·L-1稀硫酸 | 向试管中加入少量固体 | ||
4 | 3.0 | 2.0 | 3.0 | 2.0 | _____________ | t |
③若该小组同学提出的假设成立,应观察到的现象是______________________。
【题目】近年来,雾霾天气多次肆虐全国各地。其中,燃煤的烟道气和汽车尾气中含有的氮氧化合物是造成空气污染的原因之一。
(1)用CH4催化还原氮氧化物。已知CH4 (g)+2O2 (g)=CO2 (g)+2H2O (l);ΔH1=a kJ/mol,欲计算反应CH4 (g)+4NO (g)=2N2 (g)+CO2 (g)+2H2O (l)的焓变ΔH2 , 则还需要查找某化合反应的焓变ΔH3,当反应中各物质化学计量数之比为最简整数比时 ΔH3 = b kJ/mol,则该反应的热化学方程式为____________________。据此计算出ΔH2 =_______kJ/mol(用含a和b的式子表示)。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s) + 2NO(g)![]() N2 (g) + CO2 (g) ΔH。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g) + CO2 (g) ΔH。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
① T1℃时,该反应的平衡常数K=___________(保留两位小数)。
② 30 min后,改变某一条件,反应重新达到平衡,则改变的条件可能是________________。
③ 若30 min后升高温度至T2℃/span>,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的ΔH____________0(填“>”、“=”或“<”)。