题目内容
17. 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )| A. | X为直流电源的负极,Y为直流电源的正极 | |
| B. | 阳极区pH增大 | |
| C. | 图中的b>a | |
| D. | 该过程中的产品还有H2SO4 |
分析 A.根据电解质溶液中阴阳离子的移动方向确定电源的正负极;
B.阳极上亚硫酸根离子被氧化生成硫酸根离子,溶液酸性增强;
C.根据S原子守恒判断a、b大小;
D.电解池阴极上氢离子得电子,阳极上亚硫酸根离子失电子.
解答 解:A.根据阴阳离子的移动方向知,阳离子向Pt(Ⅰ)电极移动,阴离子向Pt(Ⅱ)移动,因此Pt(Ⅰ)为阴极,Pt(Ⅱ)为阳极,所以X为直流电源的负极,Y为直流电源的正极,故A正确;
B.阳极上,亚硫酸根离子被氧化生成硫酸根离子,亚硫酸是弱电解质,硫酸是强电解质,所以阳极附近氢离子浓度增大,溶液的pH减小,故B错误;
C.阳极室中,出来的硫酸中不仅有加入的稀硫酸还有亚硫酸根离子被氧化生成的硫酸,所以b>a,故C正确;
D.该电解池中阳极上生成硫酸,阴极上生成氢气,所以该过程中的产品主要为H2SO4和H2,故D正确;
故选B.
点评 本题考查学生电解池的工作原理,能正确分析图片是解本题的关键,注意图片中加入物质和析出物质的变化.

练习册系列答案
相关题目
12.某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理,下列叙述正确的是( )

| A. | 用稀硫酸代替AgNO3溶液,也可形成原电池 | |
| B. | 银片为负极,发生的反应为:Ag++e-=Ag | |
| C. | 进行实验时,琼脂中K+移向Mg(NO3)2溶液 | |
| D. | 取出盐桥,电流表依然有偏转 |
9.已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述中正确的是( )

| A. | 每生成2分子AB吸收bkJ热量 | |
| B. | 该反应中反应物的总能量高于生成物的总能量 | |
| C. | 断裂1molA-A键和1molB-B键,放出a kJ能量 | |
| D. | 该反应焓变为△H=+(a-b) kJ/mol |
12.设阿伏加德罗常数的值为NA,下列说法中正确的是( )
| A. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA | |
| B. | 0.1molCmH2n+2中含有的碳碳单键数为0.1nNA | |
| C. | 2.8g乙烯和丙烯的混合气体中所含碳原子为0.2NA | |
| D. | 1mol苯乙烯中含有的碳碳双键数为4NA |

 ;羰基硫分子的电子式为
;羰基硫分子的电子式为 .
.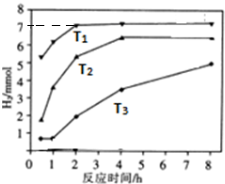
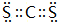 ,Y3-的立体构型为直线形.
,Y3-的立体构型为直线形.