题目内容
【题目】以某工业副产物盐泥[主要成分为Mg(OH)2,还含有少量Al(OH)3、FeCO3、MnCO3、SiO2、CaCO3等]为原料制备防火材料MgSO4·7H2O的工艺流程如图:
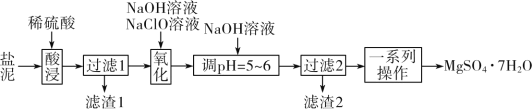
回答下列问题:
(1)以MgSO4为原料可制备阴、阳离子个数比为1:1的化合物MgC2。已知MgC2中各元素原子都达到了稳定结构,则MgC2的电子式为__。
(2)“酸浸”时,FeCO3与稀硫酸反应的化学方程式为__。滤渣1的主要成分为SiO2和__(填化学式);为了提高浸取率,除了适当增大稀硫酸的浓度和升温外,还可采取的措施有__(写出两点)。
(3)“氧化”时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为__;滤渣2的主要成分为MnO2和__、__(填化学式)。
(4)“一系列操作”主要是__。
(5)一种碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]可用作防火保温材料,用化学方程式说明其可做防火材料的原理:__。
【答案】![]() FeCO3 + H2SO4 = FeSO4 + CO2↑ + H2O CaSO4 粉碎、搅拌(或多次用硫酸浸取、减小盐泥粒度、延长浸取时间等) Mn2++ClO+2OH=MnO2↓+Cl+H2O Fe(OH)3 Al(OH)3 蒸发浓缩、冷却结晶、过滤 4MgCO3·Mg(OH)2·5H2O
FeCO3 + H2SO4 = FeSO4 + CO2↑ + H2O CaSO4 粉碎、搅拌(或多次用硫酸浸取、减小盐泥粒度、延长浸取时间等) Mn2++ClO+2OH=MnO2↓+Cl+H2O Fe(OH)3 Al(OH)3 蒸发浓缩、冷却结晶、过滤 4MgCO3·Mg(OH)2·5H2O![]() 5MgO+4CO2↑+6H2O
5MgO+4CO2↑+6H2O
【解析】
根据流程:盐泥[主要成分为Mg(OH)2,还含有少量Al(OH)3、FeCO3,MnCO3、SiO2、CaCO3等]用稀硫酸酸浸,得到MnSO4、MgSO4、Al2(SO4)3、FeSO4的混合溶液和不溶的SiO2和CaSO4,过滤,滤渣I的主要成分为SiO2和CaSO4,向滤液中加入NaOH、NaClO溶液,可以将Mn2+氧化为MnO2,将Fe2+氧化为Fe3+,调节pH在5~6时沉淀Fe3+和Al3+,过滤,滤渣2为MnO2和Fe(OH)3、Al(OH)3,最后将含有MgSO4的溶液蒸发浓缩、冷却结晶、过滤得到MgSO47H2O,据此分析作答。
⑴以MgSO4为原料可制备阴、阳离子个数比为1:1的化合物MgC2,C22含有三对共用电子对,又知MgC2中各元素原子都达到了稳定结构,则MgC2的电子式为![]() ;故答案为:
;故答案为:![]() 。
。
⑵“酸浸”时,FeCO3与稀硫酸反应的化学方程式为FeCO3 + H2SO4 = FeSO4 + CO2↑ + H2O,根据分析,滤渣I的主要成分为SiO2和CaSO4,适当增大稀硫酸的浓度、升温、粉碎、搅拌(或多次用硫酸浸取、减小盐泥粒度、延长浸取时间等)可以提高浸取率;故答案为:FeCO3 + H2SO4 = FeSO4 + CO2↑ + H2O;CaSO4;粉碎、搅拌(或多次用硫酸浸取、减小盐泥粒度、延长浸取时间等)。
⑶氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为:Mn2++ClO+2OH=MnO2↓+Cl+H2O;根据分析滤渣2的主要成分为MnO2和Fe(OH)3、Al(OH)3;故答案为:Mn2++ClO+2OH=MnO2↓+Cl+H2O;Fe(OH)3;Al(OH)3。
⑷由含有MgSO4的溶液蒸发浓缩、冷却结晶、过滤得到MgSO47H2O;故答案为:蒸发浓缩、冷却结晶、过滤。
⑸一种碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]可用作防火保温材料,用化学方程式说明其可做防火材料的原理,在高温下发生反应:4MgCO3·Mg(OH)2·5H2O![]() 5MgO+4CO2↑+6H2O,生成的MgO和CO2可以防火保温;故答案为:4MgCO3·Mg(OH)2·5H2O
5MgO+4CO2↑+6H2O,生成的MgO和CO2可以防火保温;故答案为:4MgCO3·Mg(OH)2·5H2O![]() 5MgO+4CO2↑+6H2O。
5MgO+4CO2↑+6H2O。

 阅读快车系列答案
阅读快车系列答案