��Ŀ����
����Ŀ��ijʵ��С��ͬѧΪ��̽��ͭ��Ũ����ķ�Ӧ������������ʵ�飬ʵ��װ����ͼ��ʾ��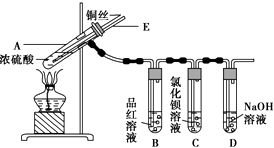
ʵ�鲽�裺
����������ͼ��ʾ��װ�ã����������ԣ��ټ����Լ���
�ڼ���A�Թܣ���B�Թ���Ʒ����Һ��ɫ��Ϩ��ƾ��ƣ�
�۽�Cu˿���ϳ鶯�뿪Һ�森
��ش��������⣺
��1��A�Թ��з�����Ӧ�Ļ�ѧ����ʽΪ ��
��2���ܹ�֤��ͭ��Ũ���ᷴӦ���������ʵ�������� ��
��3����ʢ��BaCl2��Һ��C�Թ��У����˵��ܿ��������⣬���������������������е���Һ�ֳ����ݣ��ֱ�μ�������Һ�������������Ļ�ѧʽ������ж�Ӧ��λ�ã�
�μӵ���Һ | ��ˮ | ��ˮ |
�����Ļ�ѧʽ |
д������SO2���ֻ�ԭ�Ե����ӷ�Ӧ����ʽ�� ��
��4��ʵ����Ϻ���Ϩ��ƾ��ƣ����ڵ���E�Ĵ��ڣ��Թ�B�е�Һ�岻�ᵹ�����Թ�A�У���ԭ���� ��
��5��ʵ����Ϻ�װ���в����������ж������ܴ����ϵĽ�����Ϊ�˷�ֹ�����������������Ⱦ���������װ��ǰ��Ӧ����ȡ�IJ����� ��
��6����SO2����ͨ�뺬��n mol Na2S����Һ�У���ַ�Ӧ����Һ�г��ֻ�ɫ���ǣ��Է�������Һ���������SO2����mol���������ܽ��SO2����
���𰸡�
��1��Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O
CuSO4+SO2��+2H2O
��2��B�Թ���Ʒ����Һ��ɫ
��3��Cl2+SO2+2H2O=4H++2Cl��+SO42����Ba2++SO42��=BaSO4����SO2+2NH3+H2O=��NH4��2SO3��SO32��+Ba2+=BaSO3����SO2+Cl2+2H2O=4H++SO42��+2Cl������Ba2++SO2+Cl2+2H2O=BaSO4��+4H++2Cl����
��4����A�Թ�������ѹǿ��Сʱ��������E���ܽ���A�Թ��У�ά��A�Թ���ѹǿƽ��
��5����E���ܿ���A�Թ��л����ع��������Ŀ�������������SO2�������NaOH��Һ�У�ʹ֮����ȫ����
��6��2.5n
���������⣺��1��ͭ��Ũ���Ṳ����������ͭ�����������ˮ����Ӧ����ʽΪ��Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O�����Դ��ǣ�Cu+2H2SO4��Ũ��
CuSO4+SO2��+2H2O�����Դ��ǣ�Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O����2��SO2�ܺ���ɫ���ʷ�Ӧ������ɫ���ʶ�����Ư���ԣ�SO2��Ư��Ʒ����Һ��ֻҪB����Һ��ɫ��˵��ͭ��Ũ���ᷢ����Ӧ�����Դ��ǣ�B�Թ���Ʒ����Һ��ɫ����3��SO2���л�ԭ�ԣ��ܱ�ǿ�����������������ᣬCl2����ǿ�����ԣ���ˮ��Һ���ܽ�SO2����Ϊ���ᣬ�����BaCl2��Һ�������ֽⷴӦ����BaSO4 �� ���ӷ���ʽΪCl2+SO2+2H2O=4H++2Cl��+SO42����Ba2++SO42��=BaSO4����SO2��������������ܺͼ���Һ��Ӧ�����������Σ��������κ�BaCl2��Һ�������ֽⷴӦ����BaSO3 �� ��Ӧ����ʽΪSO2+2NH3+H2O=��NH4��2SO3��SO32��+Ba2+=BaSO3���������������ֻ�ԭ�Ե����ӷ�Ӧ����ʽΪSO2+Cl2+2H2O=4H++SO42��+2Cl������Ba2++SO2+Cl2+2H2O=BaSO4��+4H++2Cl�������Դ��ǣ�BaSO4��BaSO3��SO2+Cl2+2H2O=4H++SO42��+2Cl������Ba2++SO2+Cl2+2H2O=BaSO4��+4H++2Cl��������4����A������ѹǿ��Сʱ��������ѹ���䣬������E����A��ʹA��ѹǿƽ�⣬����B��ѹǿ������������� ���Դ��ǣ���A�Թ�������ѹǿ��Сʱ��������E���ܽ���A�Թ��У�ά��A�Թ���ѹǿƽ�⣻��5��SO2�ж�����ֱ���ſգ�Ϊ��ֹSO2��Ⱦ������Ӧ�ý�װ��������ȫ��ͨ��NaOH��Һ�У�ʹSO2����ȫ���գ��������������Ϊ��E�ܿ���A�л������������������������Ķ����������NaOH��Һ�У�ʹ����ȫ�����գ�
CuSO4+SO2��+2H2O����2��SO2�ܺ���ɫ���ʷ�Ӧ������ɫ���ʶ�����Ư���ԣ�SO2��Ư��Ʒ����Һ��ֻҪB����Һ��ɫ��˵��ͭ��Ũ���ᷢ����Ӧ�����Դ��ǣ�B�Թ���Ʒ����Һ��ɫ����3��SO2���л�ԭ�ԣ��ܱ�ǿ�����������������ᣬCl2����ǿ�����ԣ���ˮ��Һ���ܽ�SO2����Ϊ���ᣬ�����BaCl2��Һ�������ֽⷴӦ����BaSO4 �� ���ӷ���ʽΪCl2+SO2+2H2O=4H++2Cl��+SO42����Ba2++SO42��=BaSO4����SO2��������������ܺͼ���Һ��Ӧ�����������Σ��������κ�BaCl2��Һ�������ֽⷴӦ����BaSO3 �� ��Ӧ����ʽΪSO2+2NH3+H2O=��NH4��2SO3��SO32��+Ba2+=BaSO3���������������ֻ�ԭ�Ե����ӷ�Ӧ����ʽΪSO2+Cl2+2H2O=4H++SO42��+2Cl������Ba2++SO2+Cl2+2H2O=BaSO4��+4H++2Cl�������Դ��ǣ�BaSO4��BaSO3��SO2+Cl2+2H2O=4H++SO42��+2Cl������Ba2++SO2+Cl2+2H2O=BaSO4��+4H++2Cl��������4����A������ѹǿ��Сʱ��������ѹ���䣬������E����A��ʹA��ѹǿƽ�⣬����B��ѹǿ������������� ���Դ��ǣ���A�Թ�������ѹǿ��Сʱ��������E���ܽ���A�Թ��У�ά��A�Թ���ѹǿƽ�⣻��5��SO2�ж�����ֱ���ſգ�Ϊ��ֹSO2��Ⱦ������Ӧ�ý�װ��������ȫ��ͨ��NaOH��Һ�У�ʹSO2����ȫ���գ��������������Ϊ��E�ܿ���A�л������������������������Ķ����������NaOH��Һ�У�ʹ����ȫ�����գ�
���Դ��ǣ���E���ܿ���A�Թ��л����ع��������Ŀ�������������SO2�������NaOH��Һ�У�ʹ֮����ȫ���գ���6��SO2���������ԣ��ܺ�Na2S��Ӧ����S���ʣ������ն����������ʱ�������������ƺ�S����Ӧ����ʽΪ5SO2+2Na2S+2H2O=3S��+4NaHSO3 �� ��������յĶ����������ʵ���Ϊx��
5SO2+2Na2S+2H2O=3S��+4NaHSO3 ��
5mol 2mol
x nmol
5mol��2mol=x��nmol
x= ![]() =2.5nmol��
=2.5nmol��
���Դ��ǣ�2.5n��

����Ŀ��Ϊ��̽��H2O2��H2SO3��Br2�����Ե����ǿ�����������ʵ�飨�г���������ȥ������ش��������⣺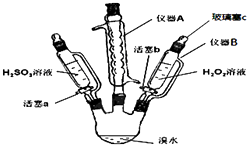
��1������A������ �� �������� ��
��2��������B�μ�Һ�岢����Ҫ������c��ԭ���� ��
��3��ʵ���¼���£��벹ȫ�հף���
���� | ʵ����� | ʵ������ | ʵ����� |
�� | ����a����μ���H2SO3��Һ������ | ||
�� | �����������Һ����μ���H2O2��Һ | �տ�ʼ��Һ��ɫ�����Ա仯�������μӣ���Һ��Ϊ�Ȼ�ɫ |
��4��������У���ʼʱ��ɫ�����Ա仯��ԭ���ǣ�д��һ���� �� ������з�Ӧ�����ӷ���ʽ ��
���������Ҫ��Ӧ�����ӷ���ʽ ��
