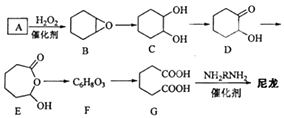
题目内容
【题目】下列说法正确的是( )。
A. 6.02×1023就是阿伏加德罗常数 B. 1mol Cl2含有2NA个氯原子
C. 摩尔既可表示质量,又可以表示数量 D. 32g O2所含O2的摩尔数是1mol
【答案】B
【解析】A.阿伏加德罗常数近似为6.02×1023mol-1,A错误;B.1molCl2含有2mol氯原子,含有2NA个氯原子,B正确;C.质量单位为g,数量单位为个,而摩尔为物质的量的单位,表示的是一定数目的微观粒子的集体,C错误;D.32gO2所含O2的物质的量为:32g÷32g/mol=1mol,不是摩尔数为1mol,D错误;答案选B。

 名校课堂系列答案
名校课堂系列答案【题目】某学生欲通过实验方法验证Fe2+的性质.
(1)该同学在实验前,依据Fe2+的性,填写了下表.
实验操作 | 预期现象 | 反应的离子方程式 |
向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO |
依照表中操作,该同学进行实验.观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.
(2)为了进一步探究溶液变成深棕色的原因,该同学进行如下实验.向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者(加了数滴浓硝酸的FeSO4溶液)变红.该现象的结论是 .
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化.
ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.
ⅲ.为与ⅰ中实验进行对照,更换丙、丁后(溶质不变),使甲中反应继续,观察到的现象与步骤ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是;
②装置乙的作用是;
③步骤ⅱ的目的是;
④该实验可得出的结论是 .
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是 .
【题目】将甲、乙两种有机混合物在常温常压下分离,已知它们的物理性质如下:
物质 | 密度(g/ml﹣3) | 沸点(℃) | 水溶性 | 溶解性 |
甲 | 0.7893 | 78.5 | 溶 | 溶于乙 |
乙 | 1.220 | 100.7 | 溶 | 溶于甲 |
则采用的分离方法是( )
A.分液
B.蒸馏
C.干馏
D.萃取
【题目】某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示.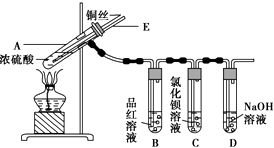
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液退色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面.
请回答下列问题:
(1)A试管中发生反应的化学方程式为 .
(2)能够证明铜与浓硫酸反应生成气体的实验现象是 .
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置.
滴加的溶液 | 氯水 | 氨水 |
沉淀的化学式 |
写出其中SO2表现还原性的离子反应方程式: .
(4)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是 .
(5)实验完毕后,装置中残留的气体有毒,不能打开导管上的胶塞.为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是 .
(6)将SO2气体通入含有n mol Na2S的溶液中,充分反应后,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体mol(不考虑溶解的SO2).