��Ŀ����
����Ŀ��Ϊ��̽��H2O2��H2SO3��Br2�����Ե����ǿ�����������ʵ�飨�г���������ȥ������ش��������⣺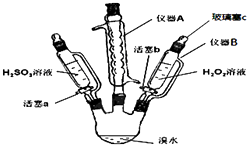
��1������A������ �� �������� ��
��2��������B�μ�Һ�岢����Ҫ������c��ԭ���� ��
��3��ʵ���¼���£��벹ȫ�հף���
���� | ʵ����� | ʵ������ | ʵ����� |
�� | ����a����μ���H2SO3��Һ������ | ||
�� | �����������Һ����μ���H2O2��Һ | �տ�ʼ��Һ��ɫ�����Ա仯�������μӣ���Һ��Ϊ�Ȼ�ɫ |
��4��������У���ʼʱ��ɫ�����Ա仯��ԭ���ǣ�д��һ���� �� ������з�Ӧ�����ӷ���ʽ ��
���������Ҫ��Ӧ�����ӷ���ʽ ��
���𰸡�
��1�����������ܣ����������壬������ӷ�
��2����Һ©��������ƿ��ͨ����ѹ���
��3���Ȼ�ɫ��ȥ��Br2�������Դ���H2SO3��H2O2�������Դ���Br2
��4������1��H2SO3�й�����H2O2�Ⱥ�H2SO3��Ӧ��H2SO3+Br2+H2O=4H++SO ![]() +2Br����H2O2+2Br��+2H+=Br2+2H2O
+2Br����H2O2+2Br��+2H+=Br2+2H2O
���������⣺��1������A����������������ܣ���������ʹ�������������������Դ��ǣ����������ܣ����������壬������ӷ�����2��������B�μ�Һ�岢����Ҫ������c��ԭ���Ǹ�����������ƿ��ͨ����ѹ��ȣ�Һ����˳�����������Դ��ǣ���Һ©��������ƿ��ͨ����ѹ��ȣ���3������a����μ���H2SO3��Һ��������H2SO3����ˮ��������Һ�ijȻ�ɫ��ȥ��˵���嵥�ʵ�������ǿ��������������������Һ����μ���H2O2��Һ����Һ�ֱ�Ϊ�Ȼ�ɫ��˵���������⽫����������Ϊ�嵥�ʣ���H2O2�������Դ���Br2 �� ���Դ��ǣ�
���� | ʵ����� | ʵ������ | ʵ����� |
�� | ����a����μ���H2SO3��Һ������ | �Ȼ�ɫ��ȥ | Br2�������Դ���H2SO3 |
�� | �����������Һ����μ���H2O2��Һ | �տ�ʼ��Һ��ɫ�����Ա仯�������μӣ���Һ��Ϊ�Ȼ�ɫ | H2O2�������Դ���Br2 |
����4��������У���ʼʱ��ɫ�����Ա仯��������Ϊ������1��H2SO3�й�����H2O2�Ⱥ�H2SO3��Ӧ����H2O2Ũ��С��Br����H2O2��Ӧ���ȣ�������У����������嵥�ʷ�Ӧ���ӷ���ʽΪ��H2SO3+Br2+H2O=4H++SO ![]() +2Br�� �� ���������Ҫ������������������ӵķ�Ӧ�����ӷ���ʽΪ��H2O2+2Br��+2H+=Br2+2H2O�����Դ��ǣ�����1��H2SO3�й�����H2O2�Ⱥ�H2SO3��Ӧ��H2SO3+Br2+H2O=4H++SO
+2Br�� �� ���������Ҫ������������������ӵķ�Ӧ�����ӷ���ʽΪ��H2O2+2Br��+2H+=Br2+2H2O�����Դ��ǣ�����1��H2SO3�й�����H2O2�Ⱥ�H2SO3��Ӧ��H2SO3+Br2+H2O=4H++SO ![]() +2Br����H2O2+2Br��+2H+=Br2+2H2O��
+2Br����H2O2+2Br��+2H+=Br2+2H2O��

 С�����ϵ�д�
С�����ϵ�д�����Ŀ�����ס��������л�������ڳ��³�ѹ�·��룬��֪���ǵ������������£�
���� | �ܶȣ�g/ml��3�� | �е㣨�棩 | ˮ���� | �ܽ��� |
�� | 0.7893 | 78.5 | �� | ������ |
�� | 1.220 | 100.7 | �� | ���ڼ� |
����õķ��뷽���ǣ� ��
A.��Һ
B.����
C.����
D.��ȡ
����Ŀ��ijʵ��С��ͬѧΪ��̽��ͭ��Ũ����ķ�Ӧ������������ʵ�飬ʵ��װ����ͼ��ʾ��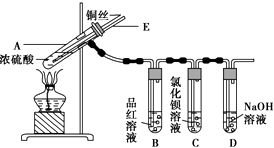
ʵ�鲽�裺
����������ͼ��ʾ��װ�ã����������ԣ��ټ����Լ���
�ڼ���A�Թܣ���B�Թ���Ʒ����Һ��ɫ��Ϩ��ƾ��ƣ�
�۽�Cu˿���ϳ鶯�뿪Һ�森
��ش��������⣺
��1��A�Թ��з�����Ӧ�Ļ�ѧ����ʽΪ ��
��2���ܹ�֤��ͭ��Ũ���ᷴӦ���������ʵ�������� ��
��3����ʢ��BaCl2��Һ��C�Թ��У����˵��ܿ��������⣬���������������������е���Һ�ֳ����ݣ��ֱ�μ�������Һ�������������Ļ�ѧʽ������ж�Ӧ��λ�ã�
�μӵ���Һ | ��ˮ | ��ˮ |
�����Ļ�ѧʽ |
д������SO2���ֻ�ԭ�Ե����ӷ�Ӧ����ʽ�� ��
��4��ʵ����Ϻ���Ϩ��ƾ��ƣ����ڵ���E�Ĵ��ڣ��Թ�B�е�Һ�岻�ᵹ�����Թ�A�У���ԭ���� ��
��5��ʵ����Ϻ�װ���в����������ж������ܴ����ϵĽ�����Ϊ�˷�ֹ�����������������Ⱦ���������װ��ǰ��Ӧ����ȡ�IJ����� ��
��6����SO2����ͨ�뺬��n mol Na2S����Һ�У���ַ�Ӧ����Һ�г��ֻ�ɫ���ǣ��Է�������Һ���������SO2����mol���������ܽ��SO2����
����Ŀ�����и���ʵ��������������ó��Ľ�����ȷ����( )
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ������Xͨ��Ʒ����Һ�� | ��ɫ��ȥ | Xһ����SO2 |
B | ����ɫ��Һ�м������ữ��BaCl2��Һ | �а�ɫ���� | ԭ��Һ��һ����SO |
C | ��Na2SiO3��Һ��ͨ������CO2���� | ���ְ�ɫ���� | H2CO3�����Ա�H2SiO3ǿ |
D | ��ij��Һ���ȼ���ˮ�ټ�KSCN��Һ | ��Һ��Ѫ��ɫ | ԭ��Һ��һ����Fe2�� |
A. A B. B C. C D. D