题目内容
【题目】现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下:

请回答下列问题:
(1)若规定气体的流动方向为从左到右,则组合实验装置时各仪器的连接顺序是:空气→Ⅳ→________→________→________(填“Ⅰ、Ⅱ、Ⅲ”,仪器不能重复使用)。
(2)装置Ⅳ中盛放的药品是___________,其作用是____________________。
(3)装置Ⅱ的作用是_________________________________________。
(4)加热装置Ⅰ时发生反应的化学方程式为___________________________。
(5)下列对于过氧化钠的叙述中,正确的是___________。
A.过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物
B.将过量Na2O2投入紫色石蕊试液中,溶液变蓝
C.过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂
D.过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂
【答案】 Ⅲ Ⅰ Ⅱ 氢氧化钠溶液 吸收通入空气中的二氧化碳 防止空气中的水蒸气和二氧化碳进入装置Ⅰ 2Na+O2 ![]() Na2O2 D
Na2O2 D
【解析】装置Ⅳ中盛放的溶液为氢氧化钠,空气进入装置Ⅳ,目的除去空气中二氧化碳,然后进入Ⅲ装置,进行气体的干燥后,气体进入Ⅰ装置,与金属钠反应,装置Ⅱ与Ⅰ装置进行连接,保证外界空气中的水蒸气和二氧化碳气体不能进入装置Ⅰ,干扰实验;
(1)Ⅲ; Ⅰ; Ⅱ;
(2)氢氧化钠溶液;吸收通入空气中的二氧化碳;
(3)防止空气中的水蒸气和二氧化碳进入装置Ⅰ
(4)2Na+O2 ![]() Na2O2 ;
Na2O2 ;
(5)A.Na2O2能够与酸反应,生成盐和氧气、水,不属于碱性氧化物;A错误;B. Na2O2与水反应生成氢氧化钠,紫色石蕊试液遇碱变蓝,Na2O2具有强氧化性,过量的Na2O2能够使蓝色溶液褪色,B错误;C.Na2O2与水反应时,Na2O2中的-1价的O,既被氧化为O2,又被还原为-2价O, Na2O2既做氧化剂又做还原剂;C错误;D.Na2O2与CO2反应时,Na2O2中的-1价的O元素,既被氧化为O2,又被还原为-2价O, Na2O2既做氧化剂又做还原剂;D正确;正确选项:D。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示.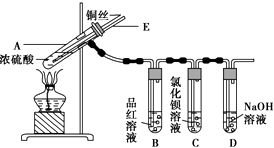
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液退色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面.
请回答下列问题:
(1)A试管中发生反应的化学方程式为 .
(2)能够证明铜与浓硫酸反应生成气体的实验现象是 .
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置.
滴加的溶液 | 氯水 | 氨水 |
沉淀的化学式 |
写出其中SO2表现还原性的离子反应方程式: .
(4)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是 .
(5)实验完毕后,装置中残留的气体有毒,不能打开导管上的胶塞.为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是 .
(6)将SO2气体通入含有n mol Na2S的溶液中,充分反应后,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体mol(不考虑溶解的SO2).