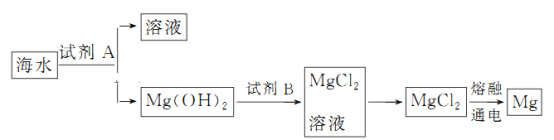
题目内容
【题目】温度25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lg c(S2-)与lg c(M2+)关系如图所示。下列说法不正确的是
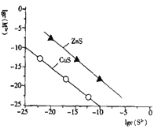
A.25℃时,Ksp(CuS)约为l×10-35
B.向Cu2+浓度为10-5mol/L废水中加入ZnS粉末,会有CuS沉淀析出
C.向l00mL浓度均为10-5mol/L Zn2+、Cu2+的混合溶液中逐滴加入10-4mol/L的Na2S溶液,Cu2+先沉淀
D.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
【答案】D
【解析】
A.在25℃时,CuS饱和溶液中存在沉淀溶解平衡:CuS(s)![]() Cu2+(aq)+S2-(aq),Ksp(CuS)=c(Cu2+)×c(S2-)=10-25×10-10=10-35,A正确;
Cu2+(aq)+S2-(aq),Ksp(CuS)=c(Cu2+)×c(S2-)=10-25×10-10=10-35,A正确;
B.由于在25℃下,CuS溶液的是Ksp=10-35<Ksp(ZnS),故向Cu2+浓度为10-5mol/L废水中加入ZnS粉末,会有CuS沉淀析出,B正确;
C.依据此图可知,在该条件下,Q> Ksp(ZnS)> Ksp(CuS),故CuS最难溶,那么首先出现的沉淀是CuS,C正确;
D.Na2S溶液中S元素的存在形式为:S2-、HS-、H2S、且存在Na元素的物质的量为S元素物质的量的2倍:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+),D错误;
答案选D。

练习册系列答案
相关题目