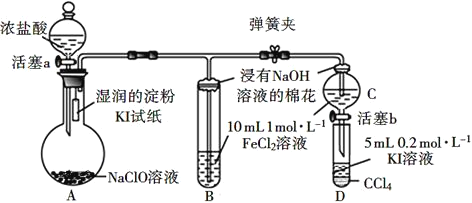
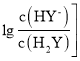题目内容
【题目】聚乳酸的结构简式如图 a,下列叙述错误的是
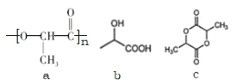
A.b 是合成聚乳酸的单体
B.1mol 乳酸与足量钠反应,生成 2mol 氢气
C.n mol 乳酸缩聚生成图 a 结构,同时生成 n molH2O
D.c 属于环酯,1molc 水解消耗 2molNaOH
【答案】B
【解析】
A.由聚乳酸的结构简式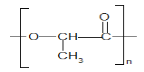 可知,它是由乳酸发生缩聚反应得到的,它的单体是乳酸,结构简式为
可知,它是由乳酸发生缩聚反应得到的,它的单体是乳酸,结构简式为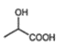 ,故A正确;
,故A正确;
B.由乳酸结构简式 可知,该结构中有羧基、醇羟基,均能与Na反应,化学方程式为
可知,该结构中有羧基、醇羟基,均能与Na反应,化学方程式为 +2Na
+2Na![]()
![]() +H2↑,则1mol 乳酸与足量钠反应,生成 1mol 氢气,故B错误;
+H2↑,则1mol 乳酸与足量钠反应,生成 1mol 氢气,故B错误;
C.乳酸发生缩聚反应生成聚乳酸的化学方程式为n
![]()
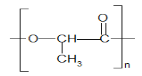 +nH2O,n mol 乳酸反应生成nmolH2O,故C正确;
+nH2O,n mol 乳酸反应生成nmolH2O,故C正确;
D.由c的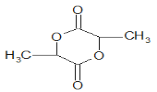 结构简式可知,c 属于环酯,c与NaOH发生水解反应的化学方程式为
结构简式可知,c 属于环酯,c与NaOH发生水解反应的化学方程式为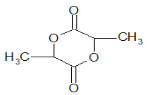 +2NaOH
+2NaOH![]() 2
2![]() ,则1molc 水解消耗 2molNaOH,故D正确;
,则1molc 水解消耗 2molNaOH,故D正确;
答案为B。

 名校课堂系列答案
名校课堂系列答案【题目】甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)工业上利用甲酸的能量关系转换图如图:

反应![]() 的焓变
的焓变![]() ________
________![]() 。
。
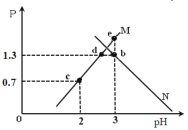
(2)某科学小组研究不同压强条件对反应![]() 的影响。
的影响。![]() 下,在一个容积可变的密闭容器中,充入一定量的
下,在一个容积可变的密闭容器中,充入一定量的![]() 和
和![]() ,测得不同压强下,平衡时容器内气体的浓度如下表:
,测得不同压强下,平衡时容器内气体的浓度如下表:
试验编号 | 反应压强 | 物质浓度 | ||
|
|
| ||
1 |
| 0.3 | 0.3 | 0.9 |
2 |
|
|
| 0.4 |
3 |
| 0.4 | 0.4 |
|
试回答以下问题:
①平衡时,实验1的正反应速率________(填“>”、“<”或“=”)实验3的逆反应速率。
②由实验1的数据可计算![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ________。
________。
③![]() ________
________![]() 。
。
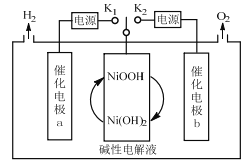
(3)经研究发现采用电还原法也可将![]() 转化为甲酸根,同时还能提高
转化为甲酸根,同时还能提高![]() 的转换效率。其电解原理如图所示,下列叙述正确的是________。
的转换效率。其电解原理如图所示,下列叙述正确的是________。
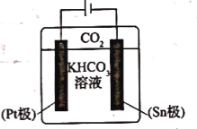
A.![]() 极的电极反应式为
极的电极反应式为![]()
B.电解过程中![]() 向
向![]() 极移动
极移动
C.![]() 极发生还原反应并有气体逸出
极发生还原反应并有气体逸出
D.电解过程中![]() 浓度逐渐减小
浓度逐渐减小
(4)甲酸的用途之一是用于配制“缓冲溶液”,在这种溶液中加入少量的强酸蚀碱,溶液的![]() 变化不大,能保持溶液
变化不大,能保持溶液![]() 相对稳定。(已知甲酸的电离平衡常数
相对稳定。(已知甲酸的电离平衡常数![]() )
)
①现将等浓度甲酸与甲酸钠溶液混合,配成![]() 的
的![]() 缓冲溶液。用离子方程式表示将少量强碱加入
缓冲溶液。用离子方程式表示将少量强碱加入![]() 缓冲溶液中,
缓冲溶液中,![]() 变化不大的原因是________。
变化不大的原因是________。
②若用![]() 溶液配制
溶液配制![]() 为4的缓冲溶液,需加入________
为4的缓冲溶液,需加入________![]() (答案保留一位小数)
(答案保留一位小数)![]() 溶液。
溶液。