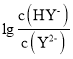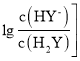题目内容
【题目】1797年法国化学家沃克兰从当时称为红色西伯利亚矿石中发现了铬,后期人类发现铬元素在其他方面有重要用途。
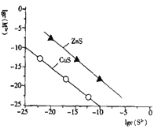
(1)Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为K____Cr (填“>”或“<”)。
(2)氮化铬(CrN)具有极高的硬度和力学强度、优异的抗腐蚀性能,请写出Cr3+基态核外电子排布式为____;CrN 晶体类型与 NaCl 晶体相同,但前者熔点(1282℃)比后者(801℃)的高,主要原因是____。
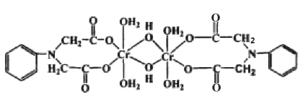
(3)Cr3+可与很多分子或离子形成配合物, 如图配合物中 Cr3+的配位数为_________,配体中采取sp3杂化的元素是__________。
(4)铬的一种氧化物的晶胞结构如图所示,其中氧离子与晶体镁堆积方式一致,铬离子在其八面体空隙中(如:CrA在O1、O2、O3、O4、O5、O6 构成的八面体空隙中)。
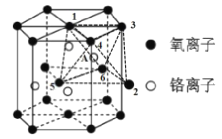
①该氧化物的化学式为 ______。
②该晶胞有 _____%八面体空隙未填充阳离子。
③已知氧离子半径a cm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为____g·cm-3(用含a、b和NA的代数式表示)。
【答案】< [Ar]3d3 氮化铬中的离子所带电荷数多,晶格能较大 6 C、N、O Cr2O3 33.3 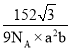
【解析】
根据离子半径和核外电子排布比较电离能大小,结合核外电子排布规律书写核外电子排布式,根据配合物理论判断离子配位数,结合杂化轨道互斥理论判断杂化方式,利用均摊法得出物质的化学式,结合立体几何知识根据公式![]() 进行晶胞的计算。
进行晶胞的计算。
(1)Cr原子的原子半径小、核电数更大,对核外电子的吸引更大,故第一电离能K<Cr;
(2)Cr为24号元素,其原子核外共有24个电子,Cr失去3个电子得到Cr3+,则Cr3+的核外电子排布式为1s22s22p63s23p63d3或[Ar]3d3,氮化铬(CrN)和NaCl均为离子晶体,氮化铬中的离子所带电荷数多,晶格能较大,所以熔点:CrN>NaCl;
(3)根据图示配合物的结构分析可知,Cr3+的配位数为6,配体中C、N、O采取sp3杂化;
(4)①有晶胞示意图可知,该晶胞中氧离子位于晶胞的顶点、面心和体内,则1个晶胞中氧离子的个数为![]() ,铬离子位于晶胞的体内,则1个晶胞中铬离子的个数为4,氧离子和铬离子的个数比为6:4=3:2,则该氧化的化学式为Cr2O3;
,铬离子位于晶胞的体内,则1个晶胞中铬离子的个数为4,氧离子和铬离子的个数比为6:4=3:2,则该氧化的化学式为Cr2O3;
②该晶胞中共有12个正八面体空隙,其中8个正八面体空隙中填充了Cr3+,则该晶胞中有4个未填充阳离子的八面体空隙,所占比例为![]() ;
;
③已知氧离子的半径为a cm,则底面边长为2a cm,又晶胞的高度为b cm,所以晶胞的体积![]() ,一个晶胞中含有2个Cr2O3,其质量
,一个晶胞中含有2个Cr2O3,其质量![]() ,所以该晶体的密度
,所以该晶体的密度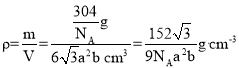 。
。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验操作不能达到相应实验目的的是( )
选项 | 实验目的 | 实验操作 |
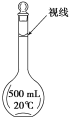
A | 配制 | 先将 |
B | 比较醋酸与碳酸酸性的强弱 | 将 |
C | 检验溶液中是否含有 | 取少量试剂于试管中,加入浓 |
D | 试清洗碘升华实验所用试管 | 先用酒精清洗,再用水冲洗 |
A.AB.BC.CD.D