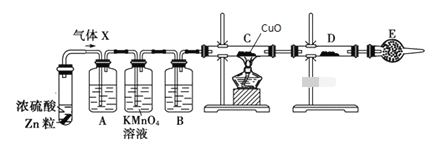
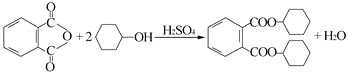
题目内容
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH+4):③>①B. 水电离出的c(H+):②>①C. ①和②等体积混合后的溶液:c(H+)=c(OH![]() )+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl
)+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl![]() )>c(OH
)>c(OH![]() )>c(H+)
)>c(H+)
【答案】B
【解析】
A.氯化铵为强电解质完全电离后产生大量的NH4+,氨水为弱电解质只有少量的NH4+产生,A正确;
B.在水中加入酸和碱都抑制水的电离,但是盐类水解促进水的电离,B项不正确。
C.盐酸和氨水混合后恰好完全反应,但因生成的盐为强酸弱碱盐,溶液显酸性,而多余的H+为水解产生,此等式可表示溶液中的质子守恒,C项正确。
D. ①和③等体积混合后的溶液显碱性,氯化铵是强电解质,而一水合氨是弱电解质,故离子浓度的大小顺序为c(NH+4)>c(Cl)>c(OH)>c(H+),D正确。
故选B。

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目