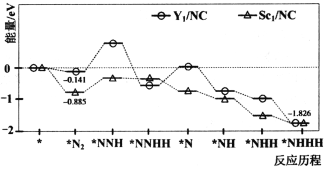
题目内容
【题目】(1)取300 mL 0.2 mol/L的 KI溶液与一定量的酸性 KMnO4 溶液恰好反应,生成等物质的量的 I2和 KIO3,则消耗 KMnO4的物质的量是___mol。
(2)在 Fe(NO3)3 溶液中加入 Na2SO3 溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是___,又变为棕黄色的原因是(用离子方程式解释)____。
(3)在 100 mLFeBr2 溶液中通入标准状况下3.36 L Cl2,溶液中有![]() 的 Br -被氧化成单质 Br2,则原 FeBr2溶液中 FeBr2 的物质的量浓度为_____mol/L。
的 Br -被氧化成单质 Br2,则原 FeBr2溶液中 FeBr2 的物质的量浓度为_____mol/L。
(4)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。
①写出该反应的化学方程式____。
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是___。
【答案】0.032mol 2Fe3++![]() +H2O=2Fe2++
+H2O=2Fe2++![]() +2H+ 3Fe2++4H++
+2H+ 3Fe2++4H++![]() =3Fe3++NO↑+H2O 2 3NF3+5H2O=9HF+2NO+HNO3 产生红棕色气体
=3Fe3++NO↑+H2O 2 3NF3+5H2O=9HF+2NO+HNO3 产生红棕色气体
【解析】
根据I元素有三分之二被氧化到0价、三分之一被氧化到+5价,利用电子转移守恒进行计算;亚硫酸根离子有较强的还原性,硝酸根离子在酸性条件下有强氧化性;亚铁离子的还原性强于溴离子;NO易被空气中的氧气氧化为红棕色的NO2。
(1)取300 mL 0.2 mol/L的 KI溶液与一定量的酸性 KMnO4 溶液恰好反应,生成等物质的量的 I2和 KIO3,KMnO4 在酸性条件下被还原为Mn2+,则该反应中I元素的化合价由-1升高到0和+5,分别升高1和6,Mn元素的化合价由+7降低到+2,共降低5,根据电子转移守恒可得,0.3L 0.2 mol/L![]() 1+0.3L 0.2 mol/L
1+0.3L 0.2 mol/L![]() 6=n(KMnO4)5,解之得,消耗 KMnO4的物质的量是0.032mol。
6=n(KMnO4)5,解之得,消耗 KMnO4的物质的量是0.032mol。
(2)在 Fe(NO3)3 溶液中加入 Na2SO3 溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色是因为铁离子被亚硫酸根离子还原为亚铁离子,该反应的离子方程式是2Fe3++![]() +H2O=2Fe2++
+H2O=2Fe2++![]() +2H+,又变为棕黄色的原因是随着溶液酸性的增强,硝酸根离子又把亚铁离子氧化为铁离子,该反应的离子方程式为3Fe2++4H++
+2H+,又变为棕黄色的原因是随着溶液酸性的增强,硝酸根离子又把亚铁离子氧化为铁离子,该反应的离子方程式为3Fe2++4H++![]() =3Fe3++NO↑+H2O。
=3Fe3++NO↑+H2O。
(3)在 100 mLFeBr2 溶液中通入标准状况下3.36 L Cl2,氯气的物质的量为0.15mol,溶液中有![]() 的 Br-被氧化成单质 Br2,氯气被还原为氯离子,亚铁离子的还原性强于溴离子,说明亚铁离子全部被氧化为铁离子,根据电子转移守恒可得n(FeBr2)1+ n(FeBr2)2
的 Br-被氧化成单质 Br2,氯气被还原为氯离子,亚铁离子的还原性强于溴离子,说明亚铁离子全部被氧化为铁离子,根据电子转移守恒可得n(FeBr2)1+ n(FeBr2)2![]() 1=0.15mol2,解之得n(FeBr2)=0.2mol,则原 FeBr2溶液中 FeBr2 的物质的量浓度为
1=0.15mol2,解之得n(FeBr2)=0.2mol,则原 FeBr2溶液中 FeBr2 的物质的量浓度为![]() 2mol/L。
2mol/L。
(4)①三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有HF、NO和HNO3,则部分N元素的化合价由+3降低到+2,另一部分N元素由+3升高到+5,其他元素的化合价没有发生变化,根据化合价升降的总数相等及质量守恒定律进行配平,该反应的化学方程式为3NF3+5H2O=9HF+2NO+HNO3。
②NF3无色、无臭,但一旦在空气中泄漏,其遇到空气中的水蒸气会生成极易被氧气氧化的NO,NO被氧化为红棕色的NO2,因此,判断该气体泄漏时的现象是:产生红棕色气体。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】乙酸丁酯的物理性质如表。
乙酸 | 1-丁醇 | 乙酸丁酯 | |
熔点(℃) | 16.6 | -89.5 | -73.5 |
沸点(℃) | 117.9 | 117 | 126.3 |
密度(g/cm3) | 1.05 | 0.81 | 0.88 |
水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
实验室用如图所示的实验装置制取乙酸丁酯。

(1)仪器A的名称___。
(2)写出制取乙酸丁酯的化学方程式:__。
(3)该实验中生成物除了主产物乙酸丁酯外,还可能生成的有机副产物有__(写出一种结构简式)。
(4)酯化反应是一个可逆反应,为提高1-丁醇的转化率,可采取的措施是__(写出两条)。
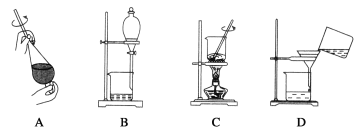
(5)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,需要的是__(填答案编号)。
(6)用60g乙酸与37g1-丁醇反应,实验中得到乙酸丁酯的质量为40.6g,则乙酸丁酯的产率为___。