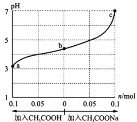
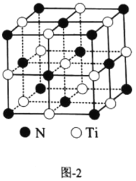
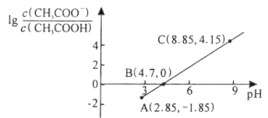
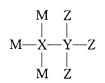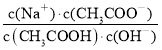题目内容
【题目】按要求完成下列问题:
(1)研究发现,在CO2低压合成甲醇反应(CO2+3H2 === CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
Co基态原子核外电子排布式为________,元素Mn与O中,第一电离能较大的是_____,基态原子核外未成对电子数较多的是________。
(2)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。
回答下列问题:
①氮原子的价电子排布图为_________。
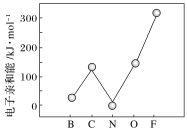
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是________;氮元素的E1呈现异常的原因是_______。
【答案】[Ar]3d74s2 O Mn ![]() 同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大 N原子的2p轨道为半充满状态,具有额外稳定性,故不易结合一个电子
同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大 N原子的2p轨道为半充满状态,具有额外稳定性,故不易结合一个电子
【解析】
根据核外电子排布规律书写核外电子排布式和价电子排布图,根据原子半径比较第一电离能大小,结合原子轨道处于半充满状态更稳定分析解答。
(1)Co为27号元素,原子核外共有27个电子,则其原子核外电子排布式为[Ar]3d74s2,由于元素Mn和O中,O为非金属元素,Mn为金属元素,且原子半径:O<Mn,所以第一电离能O>Mn,O的基态原子价电子式为2s22p4,其核外未成对电子数为2,Mn的基态原子价电子式为3d54s2,其核外未成对电子数为5,则基态原子核外未成对电子数较多的是Mn,故答案为:[Ar]3d74s2;O;Mn;
(2)①N为7号元素,原子核外电子排布式为1s22s22p3,其价电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
②同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大,但由于N原子的2p轨道为半充满状态,具有额外稳定性,故不易结合一个电子,所以除氮元素外,其他元素的E1自左而右依次增大,故答案为:同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大;N原子的2p轨道为半充满状态,具有额外稳定性,故不易结合一个电子;

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案【题目】乙酸丁酯的物理性质如表。
乙酸 | 1-丁醇 | 乙酸丁酯 | |
熔点(℃) | 16.6 | -89.5 | -73.5 |
沸点(℃) | 117.9 | 117 | 126.3 |
密度(g/cm3) | 1.05 | 0.81 | 0.88 |
水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
实验室用如图所示的实验装置制取乙酸丁酯。

(1)仪器A的名称___。
(2)写出制取乙酸丁酯的化学方程式:__。
(3)该实验中生成物除了主产物乙酸丁酯外,还可能生成的有机副产物有__(写出一种结构简式)。
(4)酯化反应是一个可逆反应,为提高1-丁醇的转化率,可采取的措施是__(写出两条)。
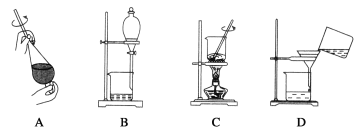
(5)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,需要的是__(填答案编号)。
(6)用60g乙酸与37g1-丁醇反应,实验中得到乙酸丁酯的质量为40.6g,则乙酸丁酯的产率为___。