题目内容
17.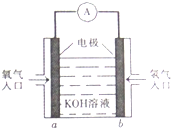 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从a、b两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从a、b两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:(1)图中通过A表的电子流动方向向左(填“向左”或“向右”),溶液中OH-的移动方向向右(填“向左”或“向右”).
(2)写出氢氧燃料电池工作时电极反应方程式:a极:2H2O+O2+4e-═4OH-,b极2H2+4OH--4e-═4H2O.
(3)若在b极改为通入甲烷,亦可构成甲烷燃料电池,写出该电池负极的电极反应式CH4+10OH--8e-═CO32-+7H2O.
分析 (1)燃料电池中电子从负极流向正极;阴离子向负极移动;
(2)氢氧燃料电池中,电解质溶液为碱,则正极上氧气得电子和水生成氢氧根离子;负极发生氧化反应;
(3)甲烷燃料电池中甲烷在负极失电子生成碳酸根离子和水.
解答 解:(1)燃料电池中燃料氢气是负极,氧气是正极,电子从负极(氢气)流向正极(氧气)所以电子流向左,氢氧根离子向负极移动,故答案为:向左;向右;
(2)氢氧燃料电池中,电解质溶液为碱,则正极上氧气得电子和水生成氢氧根离子,则其电极反应式为:2H2O+O2+4e-═4OH-,负极的电极反应为:2H2+4OH--4e-═4H2O,故答案为:2H2O+O2+4e-═4OH-;2H2+4OH--4e-═4H2O;
(3)燃料电池中,负极上燃料失电子发生氧化反应,碱性条件下,甲烷在负极生成碳酸根离子,其电极反应式为:CH4+10OH--8e-═CO32-+7H2O,故答案为:CH4+10OH--8e-═CO32-+7H2O.
点评 本题考查学生原电池的工作原理并以原电池为载体考查了反应方程式的有关计算,正确找出各物质间的关系是解本题的关键,该题综合性强,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列试剂的贮存方法错误的是( )
| A. | 钠保存在煤油中 | |
| B. | 用带磨口玻璃塞的试剂瓶盛放NaOH溶液 | |
| C. | 存放液溴时需水封 | |
| D. | 保存氯化亚铁溶液时,要加入少量的铁粉 |
8. 美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛,因而称为释迦牟尼分子(所有原子在同一平面),有关该有机分子的说法正确的是( )
美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛,因而称为释迦牟尼分子(所有原子在同一平面),有关该有机分子的说法正确的是( )
 美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛,因而称为释迦牟尼分子(所有原子在同一平面),有关该有机分子的说法正确的是( )
美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛,因而称为释迦牟尼分子(所有原子在同一平面),有关该有机分子的说法正确的是( )| A. | 该有机物属于烃的衍生物 | B. | 该有机物属于苯的同系物 | ||
| C. | 该有机物分子中含有22个碳原子 | D. | 该有机物一氯代物只有4种 |
5.下列描述中正确的是( )
| A. | ClO2-的空间构型为平面三角形 | |
| B. | SiF4和SO32-的中心原子均为sp3杂化 | |
| C. | 在所有的元素中,氟的第一电离能最大 | |
| D. | C2H5OH分子中共含有8个极性键,1个π键 |
9.下列有关丙酸的说法不正确的是( )
| A. | 丙酸遇紫色石蕊试剂变红 | B. | 丙酸与乙醇的酯化反应是取代反应 | ||
| C. | 丙酸和乙酸属于同一类物质 | D. | 丙酸可以和乙烯一样发生加成反应 |
17.下列叙述正确的是( )
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| B. | 溶于水能电离出氢离子的化合物都是酸 | |
| C. | 硫酸钡难溶于水,但硫酸钡属于强电解质 | |
| D. | 金属Cu能导电,但它不是电解质,是非电解质 |



 生成
生成 的反应类型是取代反应.
的反应类型是取代反应. 、
、 .
. .
.