题目内容
6.将一定质量的KClO3加热使其部分分解,然后向反应后的混合物中加入足量的浓硫酸并加热发生如下反应:KClO3+5KCl+3H2SO4═3Cl2+3K2SO4+3H2O,假若原氯酸钾的物质的量为m mol,第一步氯酸钾分解率为α,两步反应生成的O2与Cl2的物质的量之和为n mol,试求:计算氯元素全部转化为Cl2的α及n与m的函数关系式.分析 用a表示出分解的n(KClO3)及分解后剩余n(KClO3),根据方程式可得分解得到的n(KCl)、n(O2),再根据KClO3+5KCl+3H2SO4═3Cl2+3K2SO4+3H2O计算解答.
解答 解:分解的n(KClO3)=ma mol,剩余的n′(KClO3)=m(1-a)mol,
2 KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2 KCl+3 O2↑
ma mol ma mol 1.5ma mol
由KClO3+5KCl+3H2SO4=3Cl2↑+3K2SO4+3H2O,可知m(1-a)mol:ma mol=1:5,解得a=$\frac{5}{6}$,
根据氯元素守恒:n(Cl2)=0.5m mol,故O2和Cl2的总物质的量为:0.5m mol+1.5m mol×$\frac{5}{6}$=1.75m mol,即n=1.75m,
答:氯元素全部转化为Cl2时a=$\frac{5}{6}$、n=1.75m.
点评 本题考查混合物计算、化学方程式计算,侧重考查学生的分析计算能力,难度中等.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
16.下列物质中,既有离子键,又含有共价键的是( )
| A. | C2H6 | B. | MgCl2 | C. | HNO3 | D. | NaOH |
14.10g含有杂质的CaCO3和足量的盐酸反应,产生的CO2 0.1mol,则此样品中可能含有的杂质是( )
| A. | KHCO3和MgCO3 | B. | MgCO3和SiO2 | C. | K2CO3和 SiO2 |
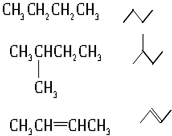
1.下列有机物不是同一种物质的是( )
| A. |  和 和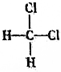 | B. | C(CH3)3C(CH3)3和CH3(CH2)3C(CH3)3 | ||
| C. | CH2═CH-CH═CH2和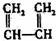 | D. | 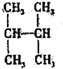 和 和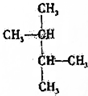 |
6.下列有关说法不正确的是( )
| A. | 胶体的丁达尔效应与微粒直径大小有关 | |
| B. | 电解质溶液的导电能力与溶液中离子浓度及离子所带电荷多少有关 | |
| C. | CaO的水溶液能够导电,因此Ca0是电解质 | |
| D. | 向饱和氯化钠溶液中加人一小块钠,溶液中有固体析出 |
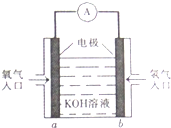 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从a、b两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从a、b两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: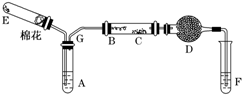 如图所示为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出).图中,A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水硫酸铜粉末,D为碱石灰,F为新制的Cu(OH)2悬浊液.(提示:乙醇催化氧化产物与新制Cu(OH)2悬浊液共热有砖红色沉淀生成)
如图所示为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出).图中,A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水硫酸铜粉末,D为碱石灰,F为新制的Cu(OH)2悬浊液.(提示:乙醇催化氧化产物与新制Cu(OH)2悬浊液共热有砖红色沉淀生成)
 写出下列物质的分子式:
写出下列物质的分子式: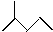 C6H14
C6H14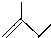 C5H10
C5H10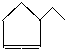 C7H12.
C7H12.