题目内容
5.下列描述中正确的是( )| A. | ClO2-的空间构型为平面三角形 | |
| B. | SiF4和SO32-的中心原子均为sp3杂化 | |
| C. | 在所有的元素中,氟的第一电离能最大 | |
| D. | C2H5OH分子中共含有8个极性键,1个π键 |
分析 A、根据价层电子对互斥理论确定粒子的空间构型;
B、根据中心原子的价层电子对数判断杂化方式;
C、同周期稀有气体的第一电离能最大,同族自上而下第一电离能降低;
D、共价化合物中不同原子之间形成的是极性键,双键中一个为δ键,一个为π键;
解答 解:A.ClO2-中价层电子对个数=$\frac{7+1}{2}$=4,且含有2个孤电子对,所以其空间构型为V型,故A错误;
B.SiF4中价层电子对个数=4+$\frac{1}{2}$(4-4×1)=4,SO32-中价层电子对个数=3+$\frac{1}{2}$(6+2-3×2)=4,所以SiF4和SO32-的中心原子均为sp3杂化,故B正确;
C、稀有气体的原子结构是稳定结构,同周期稀有气体的第一电离能最大,同族自上而下第一电离能降低,故氦元素的第一电离能最大,故C错误;
D.C2H5OH分子中共含有7个极性键,碳碳之间是非极性键,没有π键,故D错误;
故选:B.
点评 本题考查较为综合,涉及中心原子的杂化类型和分子、离子的空间构型的判断等,注意判断中心原子形成的δ键和孤电子对数为解答该题的关键,题目难度不大.

练习册系列答案
相关题目
15.下列有机化合物的分类不正确的是( )
| A. |  苯的同系物 | B. |  芳香化合物 | C. |  烯烃 | D. |  醇 |
16.下列物质中,既有离子键,又含有共价键的是( )
| A. | C2H6 | B. | MgCl2 | C. | HNO3 | D. | NaOH |
13.元素是组成世界万物的基本成分,下列关于元素的说法不正确的是( )
| A. | 氯原子和氯离子都属于氯元素 | |
| B. | 合金中一定含有金属元素 | |
| C. | 人体缺铁元素会引起贫血 | |
| D. | 碳和碘元素都是人体不可缺少的微量元素 |
20.下列关于如图所示原电池装置的叙述中,正确的是( )


| A. | 每当Zn片质量减少65克,Cu片会产生22.4L气体 | |
| B. | 溶液的pH逐渐减小 | |
| C. | 电子从锌片经导线流向铜片 | |
| D. | 氢离子在铜片表面被氧化 |
14.10g含有杂质的CaCO3和足量的盐酸反应,产生的CO2 0.1mol,则此样品中可能含有的杂质是( )
| A. | KHCO3和MgCO3 | B. | MgCO3和SiO2 | C. | K2CO3和 SiO2 |

 .元素⑨的基态原子的价电子排布式为1s22s22p63s23p63d104s2.
.元素⑨的基态原子的价电子排布式为1s22s22p63s23p63d104s2.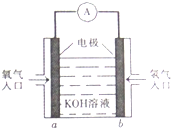 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从a、b两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从a、b两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: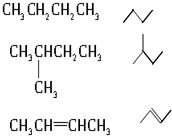 写出下列物质的分子式:
写出下列物质的分子式: C6H14
C6H14 C5H10
C5H10 C7H12.
C7H12.