��Ŀ����
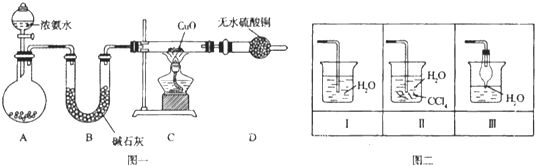
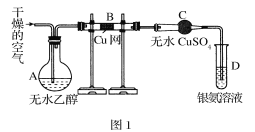
����Ŀ����������� (Na2S2O3)�����������о��й㷺Ӧ�á���ǹ�ҵ����ȡ��������Ƶķ���֮һ��ʵ����ģ�ҵ����װ����ͼ��ʾ��
(1)������ͼװ�ý���ʵ�飬Ϊ��֤����˳�����µIJ�����_______��
(2)װ��B�����ɵ�Na2S2O3ͬʱ������CO2����Ӧ�����ӷ���ʽΪ_______���ڸ�װ����ʹ�ö�����ݵ�Ŀ����_____��
(3)װ��C�������Ǽ���װ��B��SO2������Ч����C�п�ѡ����Լ���__(����ĸ)��
a.H2O2��Һ b.��ˮ c.KMnO4��Һ d.BaCl2��Һ
(4)Na2S2O3��Һ�����ڲⶨ��ˮ��Ba2+Ũ�ȡ�
��ȡ��ˮ20.00mL�������ʵ�����ȣ���������K2Cr2O7��Һ���õ� BaCrO4 ����������ϴ�Ӻ�������ϡ���ܽ⣬��ʱ CrO42-ȫ��ת��ΪCr2O72-���ټӹ��� KI��Һ����Cr2O72- ��ַ�Ӧ��Ȼ����������Һ��ָʾ������0.100 mol/L��Na2S2O3 ��Һ���еζ���(I2 +2 S2O32-= S4O62-+ 2I-)���ζ��յ������Ϊ__________��ƽ�еζ�3�Σ�����Na2S2O3 ��Һ��ƽ������Ϊ18.00mL����÷�ˮ��Ba2+ �����ʵ���Ũ��Ϊ____mol/L��
���ڵζ������У�����ʵ����������ʵ����ƫ�ߵ���______(����ĸ)��
a.�ζ���δ��Na2S2O3��Һ��ϴ
b.�ζ��յ�ʱ���Ӷ���
c.��ƿ������ˮϴ�Ӻ�δ���и��ﴦ��
d.�ζ��ܼ��촦�ζ�ǰ�����ݣ��ζ��յ㷢��������
���𰸡���Һ©���ϿڵIJ��������߽������ϰ��۶�©�����ϵ�С�� 4SO2+2S2-+![]() =
=![]() +CO2 ����SO2����Һ�ĽӴ������ʹ��Ӧ��� bc �������һ��Na2S2O3 ��Һ��ɫ��ȥ���ڰ�����ڲ��ָ� 0.03mol/L a
+CO2 ����SO2����Һ�ĽӴ������ʹ��Ӧ��� bc �������һ��Na2S2O3 ��Һ��ɫ��ȥ���ڰ�����ڲ��ָ� 0.03mol/L a
��������
װ��A������Ũ������������Ʒ�Ӧ���ɶ���������Bװ�ã�������ݿ�������������Һ��ĽӴ������װ��B�����ö����������ƺ�̼���Ʒ�Ӧ��ȡ��������ƣ�װ��C����������������Ч������Ҫ�����Ե�ʵ������װ��D����β�����ա�
(4)�ζ������У�![]() �������������ɵⵥ�ʣ�Ȼ�����Na2S2O3��Һ�ζ����ɵĵⵥ�ʵ������Ӷ�ȷ��
�������������ɵⵥ�ʣ�Ȼ�����Na2S2O3��Һ�ζ����ɵĵⵥ�ʵ������Ӷ�ȷ��![]() ����������ȷ�������ӵ�����
����������ȷ�������ӵ�����
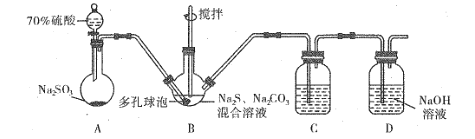
(1)��û�д�Һ©���ϿڵIJ���������û�н������ϰ��۶�©�����ϵ�С�ף���Һ©���ڵ�Һ�彫����˳�����£�Ϊ��֤����˳���������Һ©���ϿڵIJ��������߽������ϰ��۶�©�����ϵ�С�ף�
(2)������֪��ϢSO2��Na2S��Na2CO3��Ӧ����Na2S2O3��CO2���ù����ж�����������Ԫ�ػ��ϼ۽��ͣ�������������������Ԫ�ػ��ϼ���������ԭ������ϵ����غ��Ԫ���غ�ɵ����ӷ���ʽΪ��4SO2+2S2-+![]() =
=![]() +CO2���ڸ�װ����ʹ�ö�����ݿ�������Ӵ������ʹ��Ӧ��֣�
+CO2���ڸ�װ����ʹ�ö�����ݿ�������Ӵ������ʹ��Ӧ��֣�
(3)a������������Ա�˫��ˮ��������û����������a��ѡ��
b����ˮ��������������������Һ��ɫ�ᷢ���仯����bѡ��
c��������ؿ�������������������Һ��ɫ�ᷢ���仯����cѡ��
d�������������Ȼ�����Һ����Ӧ����d��ѡ��
��������ѡbc��
(4)�ٵζ��յ�ⵥ�ʱ���ȫ��Ӧ����Һ��ɫ��ȥ�����Եζ��յ������Ϊ���������һ��Na2S2O3 ��Һ��ɫ��ȥ���ڰ�����ڲ��ָ���
![]() �������������ɵⵥ�ʣ���������ԭ��Cr3+��������ת����ϵ
�������������ɵⵥ�ʣ���������ԭ��Cr3+��������ת����ϵ![]() ��3I2���ζ������з�����ӦI2 +
��3I2���ζ������з�����ӦI2 +![]() = S4O62-+ 2I-������I2��
= S4O62-+ 2I-������I2��![]() ����������
����������![]() ����ת����ϵ2Ba2+��2BaCrO4��
����ת����ϵ2Ba2+��2BaCrO4��![]() ������Ba2+��
������Ba2+��![]() ����������ϵ2Ba2+��
����������ϵ2Ba2+��![]() �����Է�Һ��Ba2+��Ũ��Ϊ
�����Է�Һ��Ba2+��Ũ��Ϊ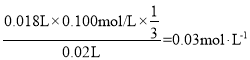 ��
��
��a���ζ���δ�ñ�Һ��ϴ����ϡ�ͱ�Һ���������ı�Һ�����ƫ�ⶨ���ƫ�ߣ�
b���ζ��յ�ʱ���Ӷ������¶���ƫС����ȡ�ı�Һ���ƫС���ⶨ���ƫ�ͣ�
c����ƿ������ˮϴ�Ӻ�δ���и��ﴦ�����Դ���Һ�����ʵ����ʵ���û��Ӱ�죬�ʶ�ʵ������Ӱ�죻
d���ζ��ܼ��촦�ζ�ǰ�����ݣ��ζ��յ㷢�������ݽ�ʹ��ȡ�ı�Һ���ƫС���ⶨ���ƫ�ͣ�
��������ѡa��