题目内容
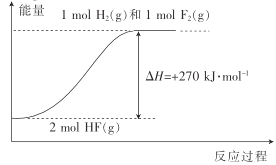
【题目】室温时,将氨水与氯化铵溶液混合得到c(NH3·H2O)+c(NH4+)=0.1mol·L-1的混合溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如图所示。下列说法正确的是
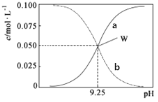
A.W点溶液中:c(H+)=c(OH-)
B.pH=8时溶液中:c(C1-)+c(OH-)=c(H+)+c(NH4+)
C.室温时NH3·H2O的电离平衡常数的值为10-9.25
D.pH=10溶液中:c(NH3·H2O)>c(NH4+)>c(OH-)>c(H+)
【答案】BD
【解析】
随pH增加,铵根的水解和一水合氨的电离均受到抑制,所以c(NH4+)下降,c(NH3H2O)上升,所以a代表一水合氨浓度,b代表铵根浓度。
A.W点溶液pH>7,溶液呈碱性,则c(OH-)>c(H+),故A错误;
B.任何电解质水溶液中都存在电荷守恒,所以pH=8时存在c(Cl-)+c(OH-)= c(H+)+ c(NH4+),故B正确;
C.W点c(NH3H2O)=c(NH4+),室温时NH3H2O的电离平衡常数K=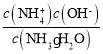 =c(OH-)=10-4.75,故C错误;
=c(OH-)=10-4.75,故C错误;
D.pH=10的溶液呈碱性,则c(OH-)>c (H+),根据图知,c (NH3H2O)>c (NH4+),所以存在c (NH3H2O)>c (NH4+)>c (OH-)>c (H+),故D正确;
故选:BD。

【题目】铋酸钠(NaBiO3)是分析化学中的重要试剂,在水中缓慢分解,遇沸水或酸则迅速分解。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:
Ⅰ.制取铋酸钠
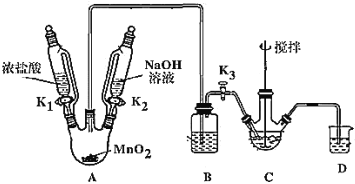
制取装置如图(加热和夹持仪器已略去),部分物质性质如下:
物质 | NaBiO3 | Bi(OH)3 |
性质 | 不溶于冷水,浅黄色 | 难溶于水;白色 |
(1)装MnO2的仪器名称是_____________,B装置用于除去HCl,盛放的试剂是________________;
(2)C中盛放Bi(OH)3与NaOH混合物,与Cl2反应生成NaBiO3,反应的离子方程式为_____;
(3)当观察到_____(填现象)时,可以初步判断 C 中反应已经完成;
(4)拆除装置前必须先除去烧瓶中残留Cl2以免污染空气,除去Cl2的操作是_______。
(5)反应结束后,为从装置C中获得尽可能多的产品,需要的操作是____________,过滤、洗涤、干燥;
Ⅱ.产品纯度的测定
(6)取上述NaBiO3产品w g,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用 c mo1/L的H2C2O4标准溶液滴定生成的MnO4-(已知:H2C2O4+MnO4---CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗V mL标准溶液。该产品的纯度为 ______________(用含 w、c、V的代数式表示)。