题目内容
2.下列有关Cl、N、S等非金属元素化合物的说法正确的是( )| A. | 漂白粉的成分为次氯酸钙,是纯净物 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理SO2和HCl废气 | |
| D. | 干燥Cl2可使干燥有色布条褪色 |
分析 A.漂白粉的主要成分是次氯酸钙和氯化钙,有效成分是次氯酸钙;
B.浓硫酸具有酸性,不能干燥碱性气体;
C.NaOH具有碱性,能吸收酸性气体;
D.能使湿润的有色布条褪色的是次氯酸而不是氯气.
解答 解:A.漂白粉的主要成分是次氯酸钙和氯化钙,有效成分是次氯酸钙,漂白粉中含有两种成分,所以漂白粉是混合物,故A错误;
B.浓硫酸具有酸性,不能干燥碱性气体,氨气属于碱性气体,能和硫酸反应生成硫酸铵,所以浓硫酸不能干燥氨气,氨气应该用碱石灰干燥,故B错误;
C.NaOH具有碱性,能吸收酸性气体,HCl和二氧化硫都属于酸性气体,能和NaOH反应生成盐,则实验室可用NaOH溶液处理SO2和HCl废气,故C正确;
D.能使湿润的有色布条褪色的是HClO而不是氯气,所以干燥Cl2不能使干燥有色布条褪色,故D错误;
故选C.
点评 本题考查气体的干燥、尾气处理、漂白原理及基本概念,明确物质的性质即可解答,注意氯气没有漂白性,为易错点.

练习册系列答案
相关题目
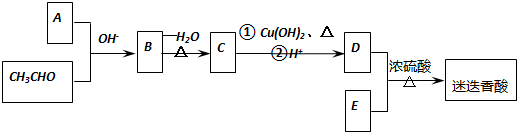
12.某密闭容器中充入等物质的量的气体A和B,一定温度下发生如下反应:A(g)+xB(g)═2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化关系如图所示.下列说法中正确的是( )


| A. | 反应方程式中的x=1,30min时改变条件后,A的转化率将变减小 | |
| B. | 前30 min内 A的反应速率为0.05 mol/(L•min) | |
| C. | 20至40 min内表示处于平衡状态,该反应为放热反应 | |
| D. | 30 min时改变的条件是加入负催化剂,40 min时改变的条件是升高温度 |
13.光具有能量,能影响很多反应.下列反应中,受光照影响显著的是( )
| A. | 铁与氯气反应 | B. | 次氯酸的分解 | ||
| C. | 乙醇与乙酸的酯化反应 | D. | 甲烷与氧气的反应 |
14.有机化学中取代反应的范畴很广.下列反应不属于取代反应范畴的是( )
| A. |  | |
| B. | CH3CH2CH2CHOHCH3$→_{△}^{浓硫酸}$CH3CH2CH=CHCH3+H2O | |
| C. | 2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O | |
| D. | CH3COOH+CH3OH $→_{△}^{浓H_{2}SO_{4}}$ CH3COOCH3+H2O |
11.有一瓶无色气体,可能含有H2S、CO2、HCl、HBr、SO2中的若干种,将其通入氯水中,得无色透明液,将此溶液分成两份,向其中一份加入盐酸酸化的BaCl2溶液有白色沉淀;向另一份中加入HNO3酸化的AgNO3溶液有白色沉淀产生,则下列结论正确的是( )
| A. | 肯定有CO2和SO2 | B. | 可能有HBr、CO2 | ||
| C. | 肯定没有HBr、H2S、HCl | D. | 以上结论均不正确 |
11.下列有关元素周期表、元素周期律的说法中不正确的是( )
| A. | 元素周期表分为7个主族、7个副族、1个0族、1个VIII族,共18个纵行 | |
| B. | 己知As元素位于第四周期VA族,故NH3比 AsH3稳定 | |
| C. | 已知Sr元素位于第五周期IIA族,故Sr(OH)2碱性比Mg(OH)2弱 | |
| D. | 副族元素中没有非金属元素 |

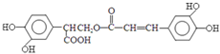
 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$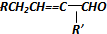
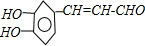 .
.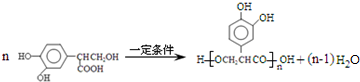 .
.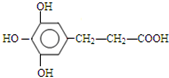 、
、 、
、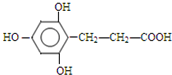 、
、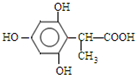 (任一种).
(任一种).