题目内容
11.有一瓶无色气体,可能含有H2S、CO2、HCl、HBr、SO2中的若干种,将其通入氯水中,得无色透明液,将此溶液分成两份,向其中一份加入盐酸酸化的BaCl2溶液有白色沉淀;向另一份中加入HNO3酸化的AgNO3溶液有白色沉淀产生,则下列结论正确的是( )| A. | 肯定有CO2和SO2 | B. | 可能有HBr、CO2 | ||
| C. | 肯定没有HBr、H2S、HCl | D. | 以上结论均不正确 |
分析 加入过量氯水后得到无色透明溶液,说明混合气体中无H2S和HBr;加入盐酸酸化的BaCl2溶液,出现白色沉淀,则说明其中肯定含有SO2,氯水中含有氯离子会与硝酸银发生反应生成氯化银沉淀,不能确定是否含有HCl,无法确定是否含有CO2.
解答 解:通入氯水得无色溶液,一定无H2S、HBr,因若有这两种气体会发生反应:H2S+Cl2=HCl+S↓、HBr+Cl2=HCl+Br2,会看到浑浊或溶液颜色发生改变;
将溶液分两份一份加HCl酸化的BaCl2有白色沉淀,一定有SO2,因SO2已被氯气氧化成SO42-;另一份加HNO3酸化的AgNO3有白色沉淀,但不能确定是否含有HCl,
因第一步反应后溶液中已经存在Cl-.CO2的存在不能确定,因二氧化碳与加入试剂不反应.
A、CO2的存在不能确定,故A错误;
B、HBr一定没有,故B错误;
C、HCl的存在不能确定,故C错误;
D、故以上结论均不正确.
故选D.
点评 本题考查物质的检验和鉴别的实验方案的设计,侧重于常见气体的性质的考查,要注意加入试剂可能含有待检验的成分,不能确定此气体的存在,题目难度不大.

练习册系列答案
相关题目
1.下列有关化学用语的表示方法中错误的是( )
| A. | CO2分子的结构式:O=C=O | |
| B. | S2-的结构示意图: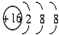 | |
| C. | R2+离子核外有a个电子,b个中子,R原子符号为:${\;}_{a+2}^{a+b+2}$R | |
| D. | 次氯酸的电子式: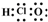 |
2.下列有关Cl、N、S等非金属元素化合物的说法正确的是( )
| A. | 漂白粉的成分为次氯酸钙,是纯净物 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理SO2和HCl废气 | |
| D. | 干燥Cl2可使干燥有色布条褪色 |
19.用括号内试剂及操作方法除去下列各物质中的少量杂质,不正确的是( )
| A. | 乙醇中的水(CaO、蒸馏) | B. | 溴乙烷中的乙醇(水、分液) | ||
| C. | 苯中的甲苯(Br2水、分液) | D. | 溴苯中的溴(NaOH溶液、分液) |
6.将SO2气体通入BaCl2溶液至饱和,未见有沉淀生成,继续通入另一种气体却有沉淀产生.则通入的气体可能是( )
①CO2 ②NH3 ③N2 ④Cl2⑤O3⑥H2 ⑦NO2.
①CO2 ②NH3 ③N2 ④Cl2⑤O3⑥H2 ⑦NO2.
| A. | ①②③④⑤ | B. | 全部 | C. | ②④⑤⑦ | D. | ①④⑤⑦ |
16.元素周期表的一部分,按要求完成各小题.(9分)
(1)化学性质最不活泼的元素Ar,非金属性最强的元素是F.(填元素符号)
(2)金属性最强的单质与水反应的化学方程式为:2K+2H2O═2KOH+H2↑①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH(写化学式).
(3)某元素的最高价氧化物的水化物既能与强酸反应生成盐A和水又能与强碱反应生成盐B与水,写出盐B溶液与小苏打溶液反应的离子方程式AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,向该元素和⑧号元素组成的化合物溶液中,缓缓滴加NaOH至过量,现象为:随着氢氧化钠的滴入,白色沉淀逐渐增加,当达到最多后又逐渐减少,最后完全消失,得到澄清溶液.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ⑥ | ⑦ | ⑨ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑪ |
(2)金属性最强的单质与水反应的化学方程式为:2K+2H2O═2KOH+H2↑①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH(写化学式).
(3)某元素的最高价氧化物的水化物既能与强酸反应生成盐A和水又能与强碱反应生成盐B与水,写出盐B溶液与小苏打溶液反应的离子方程式AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,向该元素和⑧号元素组成的化合物溶液中,缓缓滴加NaOH至过量,现象为:随着氢氧化钠的滴入,白色沉淀逐渐增加,当达到最多后又逐渐减少,最后完全消失,得到澄清溶液.
19. 乙酰苯胺具有解热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称,其制备原理如下:
乙酰苯胺具有解热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称,其制备原理如下: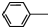 NH2+CH3COOH$\stackrel{△}{?}$
NH2+CH3COOH$\stackrel{△}{?}$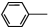 NHCOOCH3+HO
NHCOOCH3+HO
已知:
①苯胺易被氧化.
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
实验步骤如下:
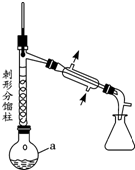
步骤1:在a中,加入9mL (0.10mol)苯胺、15mL(0.27mol)冰醋酸及少许锌粉,依照如图装置组装仪器.
步骤2:控制温度计读数在105℃左右,小火加热回流至反应完全.
步骤3:趁热将反应混合物倒入盛有100mL 冷水的烧杯中,冷却后抽滤(一种快速过滤方法)、洗涤,得到粗产品.
步骤4:将步骤3所得粗产品进一步提纯后,称得产品质量为10.8g.
请回答下列问题:
(1)仪器a的名称为圆底烧瓶,所选仪器a的最佳规格是B(填序号).
A.25mL B.50mL C.100mL D.250mL
(2)实验中加入少许锌粉的目的是防止苯胺被氧化,同时起着沸石的作用.
(3)步骤2中,控制温度计读数在105℃左右的原因是温度过低不能蒸出反应所生成的水或温度过高未反应的乙酸蒸出.
(4)判断反应已基本完全的方法为锥形瓶不再有水增加.
(5)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是冷却后固体析出粘在瓶壁上不易处理.
(6)步骤4中粗产品进一步提纯,该提纯方法是重结晶.
(7)本次实验的产率为80%.
 乙酰苯胺具有解热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称,其制备原理如下:
乙酰苯胺具有解热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称,其制备原理如下: NH2+CH3COOH$\stackrel{△}{?}$
NH2+CH3COOH$\stackrel{△}{?}$ NHCOOCH3+HO
NHCOOCH3+HO已知:
①苯胺易被氧化.
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
| 物质 | 熔点 | 沸点 | 溶解度 |
| 乙酰苯胺 | 114.3℃ | 305℃ | 微溶于冷水、易溶于热水 |
| 苯胺 | -6℃ | 184.4℃ | 微溶于水 |
| 醋酸 | 16.6℃ | 118℃ | 易溶于水 |
步骤1:在a中,加入9mL (0.10mol)苯胺、15mL(0.27mol)冰醋酸及少许锌粉,依照如图装置组装仪器.
步骤2:控制温度计读数在105℃左右,小火加热回流至反应完全.
步骤3:趁热将反应混合物倒入盛有100mL 冷水的烧杯中,冷却后抽滤(一种快速过滤方法)、洗涤,得到粗产品.
步骤4:将步骤3所得粗产品进一步提纯后,称得产品质量为10.8g.
请回答下列问题:
(1)仪器a的名称为圆底烧瓶,所选仪器a的最佳规格是B(填序号).
A.25mL B.50mL C.100mL D.250mL
(2)实验中加入少许锌粉的目的是防止苯胺被氧化,同时起着沸石的作用.
(3)步骤2中,控制温度计读数在105℃左右的原因是温度过低不能蒸出反应所生成的水或温度过高未反应的乙酸蒸出.
(4)判断反应已基本完全的方法为锥形瓶不再有水增加.
(5)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是冷却后固体析出粘在瓶壁上不易处理.
(6)步骤4中粗产品进一步提纯,该提纯方法是重结晶.
(7)本次实验的产率为80%.
20.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实 验 事 实 | 理 论 解 释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子半径小于氧原子 |
| B | 干冰的熔沸点低 | 干冰为分子晶体 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |