题目内容
17.如表为元素周期表的一部分.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ⑤ | |||||
| 三 | ③ | ⑥ | |||||
| 四 | ④ | ⑦ | |||||
(2)表中半径最大的元素是K;(写元素符号)
(3)表中元素⑤、⑥、⑦对应的单质氧化性最强的是F2;(写化学式,下同)
(4)表中元素⑥、⑦氢化物的稳定性顺序为HCl>HBr;
(5)表中元素最高价氧化物对应水化物酸性最强的酸是HClO4.
分析 由元素在周期表中位置,可知①为H、②为Li、③为Na、④为K、⑤为F、⑥为Cl、⑦为Br.
(1)同周期自左而右元素非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强;上述原子中溴的单质常温下为液态;
(2)电子层数越多,半径越大,同一周期,原子序数越小,半径越大;
(3)非金属性越强,其单质的氧化性越强;
(4)非金属性越强,其氢化物越稳定;
(5)非金属性越强,最高价含氧酸的酸性越强.
解答 解:由元素在周期表中位置,可知①为H、②为Li、③为Na、④为K、⑤为F、⑥为Cl、⑦为Br.
(1)同周期自左而右元素非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强,上述元素中F元素非金属性最强,K的金属性最强;上述原子中溴的单质常温下为液态,故答案为:F;K;Br;
(2)电子层数越多,半径越大,同一周期,原子序数越小,半径越大,故半径最大的是第四周期的IA族元素K,故答案为K;
(3)非金属性越强,其单质的氧化性越强,由于非金属性F>Cl>Br,故氧化性最强的单质是氟气,故答案为:F2;
(4)非金属性Cl>Br,非金属性越强,氢化物越稳定,则HCl>HBr,故答案为:HCl;HBr;
(5)F没有正价,则非金属性除F外,Cl的非金属性越强,最高价含氧酸的酸性越强,最高价氧化物对应水化物酸性最强的酸的分子式为HClO4,故答案为:HClO4.
点评 本题考查位置、结构与性质,为高频考点,把握元素周期表与元素周期律综合应用、周期表的结构为解答的关键,侧重对元素周期律的考查,注意对基础知识的理解掌握,题目难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
7.为把溴水中溴单质萃取出来,下列物质可达到目的是( )
| A. | 乙醇 | B. | 苯酚溶液 | C. | 直馏汽油 | D. | 乙酸 |
8.能用酸性高锰酸钾溶液鉴别的一组物质是( )
| A. | 乙醇和乙酸 | B. | 乙烷和苯 | C. | 乙烯和乙炔 | D. | 甲烷和丙烷 |
5.胶体区别于其它分散质的本质特征是( )
| A. | 分散质颗粒的大小在1-100 nm之间 | B. | 有丁达尔现象 | ||
| C. | 是均一、透明的液体 | D. | 能够稳定存在 |
12.下列金属元素中,不属于碱金属元素的是( )
| A. | Li | B. | Na | C. | Rb | D. | Mg |
6.下列表达方式错误的是( )
| A. | 氯化氢分子的电子式: | B. | 硫化氢分子的S2-的结构示意图是: | ||
| C. | O-18原子的符号:818O | D. | CO2分子的结构式:O=C=O |
12.钒是第四周期第VB族元素,V2O5是无臭有毒微溶于水的两性化合物,是一种中等强度的氧化剂.合成V2O5的工业流程图如下:
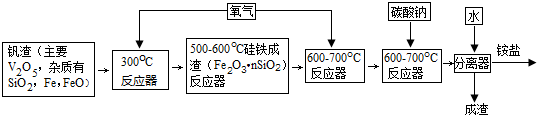
(1)V2O5与氢氧化钠反应的离子方程式:V2O5+6OH-=2VO43-+3H2O.
(2)300℃反应器主要目的是把铁氧化为四氧化三铁.
(3)600-700℃反应器通入氧气的目的是把四氧化三铁氧化为氧化铁.
(4)加入铵盐后,通过过滤、洗涤和干燥得到纯净的“黄饼”(NH4)6V10O28•nH2O.洗涤“黄饼”选用合适的试剂是C.
A.1%的氨水 B.1%的铵盐 C.5%的酒精 D.蒸馏水
(5)①“黄饼”(NH4)6V10O28•nH2O含“结晶水”占质量的20.21%,则n为15.
②对上述“黄饼”133.6g进行热重分析:
写出温度为773K所发生的化学方程式:(NH4)6V10O28•15H2O$\frac{\underline{\;高温\;}}{\;}$6NH3↑+5V2O5+18H2O.

(1)V2O5与氢氧化钠反应的离子方程式:V2O5+6OH-=2VO43-+3H2O.
(2)300℃反应器主要目的是把铁氧化为四氧化三铁.
(3)600-700℃反应器通入氧气的目的是把四氧化三铁氧化为氧化铁.
(4)加入铵盐后,通过过滤、洗涤和干燥得到纯净的“黄饼”(NH4)6V10O28•nH2O.洗涤“黄饼”选用合适的试剂是C.
A.1%的氨水 B.1%的铵盐 C.5%的酒精 D.蒸馏水
(5)①“黄饼”(NH4)6V10O28•nH2O含“结晶水”占质量的20.21%,则n为15.
②对上述“黄饼”133.6g进行热重分析:
| 温度K | 293 | 373 | 773 |
| 质量(g) | 133.6 | 106.6 | 91.0 |