题目内容
醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
| A.升高温度,平衡正向移动,醋酸的电离常数Ka值增大 |
| B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大 |
| C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D.25℃时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸 |
D
解析试题分析:弱电解质的电离平衡常数只受温度影响,升高温度电离平衡常数增大,A对;B项将溶液稀释,c(H+)减小,c(OH-)增大,B对。C项CH3COO-会抑制CH3COOH电离,正确;D项加入冰醋酸,溶液的pH、和电离程度都减小,但是电离平衡常数不变,错误。
考点:弱电解质的电离平衡。

练习册系列答案
相关题目
根据以下叙述制备氯化铜:将含有FeO杂质的CuO粉末慢慢加入浓盐酸中,充分 反应后粉末溶解。已知:FeS不溶于水,但溶于强酸。
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥9.6 | ≥6.4 |
在除去溶液中的Fe2+时,可采用的方法是
A.加入纯铜粉,将Fe2+还原为Fe
B.直接加NaOH溶液,调整溶液的pH≥9.6
C.先将Fe2+氧化成Fe3+,再调整溶液pH至3.7~4
D.通入H2S使Fe2+直接沉淀
在稀CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO- + H+,下列叙述正确的是
CH3COO- + H+,下列叙述正确的是
| A.加入水时,平衡左移 | B.加入少量0.1mol/LHCl溶液,溶液中c(H+)减小 |
| C.加入少量NaOH固体,平衡右移 | D.加入少量CH3COONa固体,平衡右移 |
关于NaHCO3溶液,下列表述不正确的是
| A.c (Na+)= c (HCO3-)+ c (CO32-)+ c (H2CO3) |
| B.c(Na+)+ c (H+)=" c" (HCO3-)+ c (CO32-)+ c (OH-) |
| C.HCO3-的水解程度大于HCO3-的电离程度 |
| D.c (H+) + c(H2CO3)=c (OH-)+ c(CO32-) |
下列事实中不能证明CH3COOH是弱电解质的是
| A.常温下某CH3COONa溶液的pH=8 |
| B.常温下0.1 mol·L-1 CH3COOH溶液的pH=2.8 |
| C.CH3COONa溶液与稀盐酸反应生成CH3COOH和NaCl |
| D.CH3COOH属于共价化合物 |
下列溶液一定呈中性的是
| A.pH=7的溶液 | B.c(H+)=c(OH-)的溶液 |
| C.非电解质溶于水得到的溶液 | D.由强酸、强碱等物质的量反应得到的溶液 |
下列关于强、弱电解质的叙述,有错误的是( )
| A.强电解质在溶液中完全电离,不存在电离平衡 |
| B.在溶液中,导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 |
| C.强电解质都是离子化合物,弱电解质都是共价化合物 |
| D.纯净的强电解质在液态时,有的导电,有的不导电 |
已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25 ℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与a mol·L-1 NaOH溶液等体积混合后,所得溶液显碱性(pH>7),则c (OH-)>c(H+)、c(Na+)>c(CN-)
C.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+) = c(OH-)+c(HCO3-)+c(CO32-)
某温度下,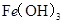
 分别在溶液中达到沉淀溶解平衡后,改变溶液
分别在溶液中达到沉淀溶解平衡后,改变溶液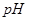 ,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
A. |
B.加适量 固体可使溶液由 固体可使溶液由 点变到 点变到 点 点 |
C.  两点代表的溶液中 两点代表的溶液中 与 与 乘积相等 乘积相等 |
D.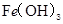 、 、 分别在 分别在 、 、 两点代表的溶液中达到饱和 两点代表的溶液中达到饱和 |